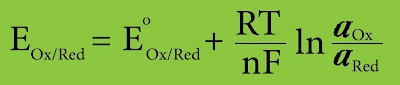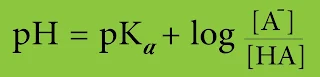معادلة نرنست Nernst Equation
إن معادلة القوة المحركة الكهربائية EMF للخلية الغلفانية التي يشكل الكترود الهيدروجين أحد قطبيها يمكن كتابتها بالشكل التالي :
ملاحظة : يمكنك عزيزي القارئ مراجعة الخلية الغلفانية من هنا
- R : ثابت الغازات العام 8.314 J / mol.K
- T : درجة الحرارة المطلقة وتقدر بالكلفن
- n : عدد الإلكترونات في نصف التفاعل Ox + ne → Red
- F : ثابت فاراداي (C 9.65×10⁴)
- EOx/Red : كمون الالكترود التوازني V
- E°Ox/Red : كمون الالكترود القياسي V
يطلق على علاقة كمون نصف التفاعل عندما αOx = αRed = 1 اسم معادلة نرنست.
ملاحظة هامة :
هنا لا بد من الإشارة إلى ضرورة حذف المكونات الصلبة والغازية عندما p = 1atm من معادلة نرنست ذلك لأن فعاليتها تساوي الواحد , ويجب أن ترفع الفعاليات للأس المساوي إلى عدد مولات المادة عند التوازن.
يبدل اللوغاريتم الطبيعي في المعادلة السابقة إلى اللوغاريتم العشري لتصبح بالشكل التالي :
فإذا كانت °T = 25 C وبعد تعويض قيم الثوابت في الحد ما قبل اللوغاريتم تصبح معادلة نرنست بالشكل التالي :
يتعلق كمون الإرجاع القياسي بكل من درجة الحرارة والضغط وطبيعة المذيب.
ويفضل في التطبيقات العملية استخدام التراكيز وليس الفعالية ويمكن كتابة معادلة نرنست في هذه الحالة بالشكل التالي :
لأن α = Cf . α حيث تمثل f معامل الفعالية
وعندما C = 1M يُعبر عن الفعالية بالشكل α = f . α ، وتمثل E'°Ox/Red كمون الإرجاع ( الإختزال) الصيغي للتفاعل النصفي الذي يعطى بالعلاقة التالية :
لو أخذنا تفاعل إرجاع ( إختزال) البرمنغنات يكتب كمون الإرجاع ( الإختزال) الصيغي بالشكل التالي :
يتضح من ذلك أن الكمون الصيغي يتعلق بالقوة الشاردية والتفاعلات الإضافية الجارية وتركيز المواد التي لا تمثل شكلاً مؤكسداً أو مرجعاً ( مختزلاً) ولكنها تؤدي دور المشارك فقط في التفاعل النصفي مثل ๋ H .
ملاحظة :
بما أن المعاملات α مرتبطة بثوابت التفاعل الإضافية فإن قياس °'E عند شروط مختلفة يمثل إحدى طرائق تحديد ثوابت استقرار المعقدات وجداء الإنحلال وغيرها.
أما بحذف التفاعلات الإضافية فتتعلق قيم °'E خطياً بالقوة الشاردية
حيث يوضح الشكل التالي تأثير القوة الشاردية في كمون الكترود كلوريد الفضة
طبعاً يعطي هذا إمكانية إيجاد الكمونات القياسية عند قوى شاردية مختلفة
حالات التشابه بين جملة حمض - أساس وجملة أكسدة - إختزال
1- يُلاحظ التشابه بين تفاعلات حمض - أساس وتفاعلات أكسدة - إختزال فمثلاً نحن نعلم أن pH يمكن كتابتها بالعلاقة التالية :
بينما يعطى الكمون بالعلاقة :
ففي كلتا الحالتين يضاف إلى القيمة القياسية حدّ يتضمن نسبة تراكيز الأشكال المرافقة. ولكن ينحصر الاختلاف في المضروب (n/0.059) في علاقة الكمون عن علاقة pH
2- يقدر الكمون بالفولت ويبقى الحد اللوغاريتمي وpH بدون واحدة.
3- تمتلك محاليل الحموض والأسس المرافقة لها مفعول وقاية المحلول من pH المحلول وذلك عند حدوث تغيرات داخل الجملة حمض - قاعدة ( أساس) وكذلك المحاليل التي لا تحتوي على أشكال Ox و Red للمادة نفسها تمتلك قدرة على مقاومة التغير في قيمة الكمون حيث أنه عند إضافة مؤكسد أو مرجع إلى هذا المحلول بصورة موافقة للشكل Ox أو Red فإنه يتفاعل ومن ثم سوفَ لن تتغير قيمة الكمون تغيراً ملحوظاً.
4- إن المذيبات المذبذبة تعدل قوة الحموض والقواعد ( الأسس) حتى الوصول إلى الشوارد الموجبة والسالبة الناتجتين من تفاعل البرتنة بين جزيئات المذيب نفسه ولكن يكون التأثير المشابه لجملة أكسدة - إختزال (إرجاع) قليل الوضوح