المحلول المنظم ( محلول موقي)
ماهو المحلول المنظم ؟
يطلق على المحاليل التي تحافظ على قيمة معينة لأي مقدار عند إجراء تغيير تركيب الماء فيها اسم المحاليل المنظمة.
تحافظ المحاليل المنظمة (حمض - قاعدة) على قيمة pH المزيج وذلك عند إضافة كميات قليلة من حمض قوي أو أساس (قاعدة) قوي.
و بالتالي يمكن القول أن المحلول المنظم عبارة عن زوج مترافق بالنسبة للنوع حمض - أساس كما ويمثل هذا الزوج أيضاً حمض - أساس. ومن الأمثلة على المحاليل المنظمة نجد :
- المحلول المنظم للخلات الذي يتألف من : CH3COOH و NaCH3COO
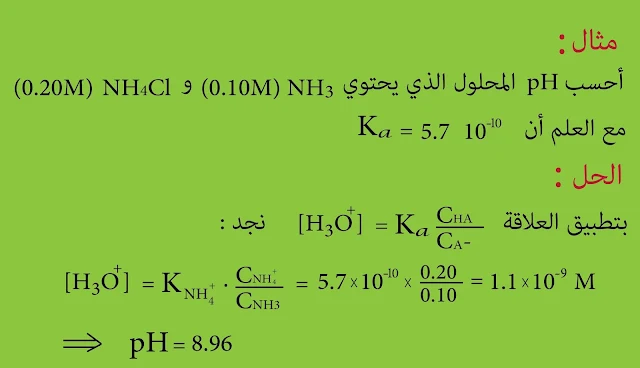
- والمحلول المنظم الأمونيومي الذي يتألف من : NH3 و NH4Cl
- والمحلول المنظم الفوسفاتي الذي يتألف من : NaH2PO4 و Na2HPO4
كما وتحافظ المحاليل المنظمة على كمون الجملة عند إدخال مؤكسد أو مرجع إلى مزيج الجملة.
كما وتوجد المحاليل المنظمة المعدنية التي تحافظ على قيمة ثابتة ل pM.
خصائص المحاليل المنظمة
- تبقى قيمة pH ثابتة عند التمديد لأن النسبة ¯CHA / CA لا تتغير.
- ولكن عند التمديد الكبير جداً يجب إدخال تشرد الماء في العمليات الحسابية حيث من الممكن أن تتغير قيمة pH من 0.5 إلى 1 .
يعمل المحلول المنظم على منع pH المحلول من التغير عند الإضافات القليلة من الحمض القوي أو الأساس القوي ونتيجة لذلك يمكن ملاحظة ما يلي :
1- في أثناء إضافة حمض قوي إلى المحلول المنظم (¯HA + A) (فرضاً) تقوم ¯A بالتقاط شوارد +H الناتجة من الحمض مشكلةً حمض ضعيف التشرد HA
A¯ + H ๋ ➡️ HA
ومن ثم يبقى التركيز الكلي للمكونيين ¯A و HA ثابتاً، ويحصل تغير في النسبة [¯A] / [HA] ولكن تغير لوغاريتم هذه النسبة يكون صغيراً.
2- في أثناء إضافة أساس (قاعدة) قوي إلى المحلول المنظم يقوم HA بالتقاط ¯OH المضاف مشكلاً الأساس ¯A
¯HA + OH¯ ➡️ H2O + A
ينزاح التوازن من اليسار إلى اليمين لتعويض الخسارة الناتجة من الحمض إلا أن التغير الذي يطرأ على قيمة النسبة بين المكونات يرافقه تغير صغير في قيمة pH المحلول.
حساب pH المحاليل المنظمة
ليكن لدينا التوازن التالي :
¯HA + H2O ⇌ H3O ๋ + A
¯A¯ + H2O ⇌ HA + OH
ينزاح كلا التوازنين بقوة نحو اليسار وذلك لأن المحلول يحتوي على كميات كافية من الحمض HA والأساس ( القاعدة) ¯A
ويعطى ثابت تشرد الحمض HA بالعلاقة التالية :
ومنه نجد :
بما أن التوازن ينزاح نحو اليسار بالتالي يمكن افتراض أن CHA ~ [HA] , وكذلك CA¯ ~ [A¯] وبالتالي تصبح العلاقة الأخيرة بالشكل التالي :
ومن هذه العلاقة نجد أن :
تدعى هذه العلاقة معادلة هندرسون - باخ
ملاحظة:
في كل ما سبق لم نأخذ بالحسبان شوارد الهيدروجين الناتجة عن تشرد الماء وذلك بسبب كبح التشرد الذاتي من قبل¯Α و HA
الآن إذا كان تفكك الحمض والأساس ملحوظاً في المحلول في هذه الحالة يكون :
CHA ≠ [HA] بالتالي CHA - [H ๋] =[HA]
و [¯A] ≠ ¯CA بالتالي [¯A] = CA¯ - [OH¯]
وهكذا إذا أدخلنا التشرد الذاتي للماء بالحسبان بالتالي يكون لدينا :
ويصبح تركيز الهيدروجين في المحلول الواقي بالشكل التالي :