تفاعلات أكسدة - اختزال | الخلية الغلفانية
يطلق على التفاعلات التي يتغير فيها رقم أكسدة المواد المتفاعلة اسم تفاعلات أكسدة - إختزال أو أكسدة - إرجاع
وهي عمليات يتم فيها اكتساب ومنح إلكترونات :
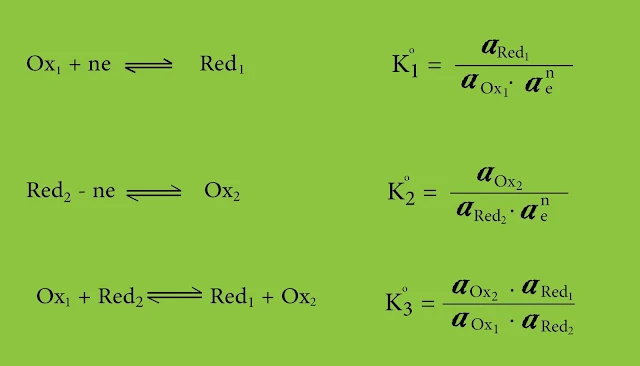
Ox1 + ne ⇌ Red1
Red2 - ne ⇌ Ox2
يقسم تفاعل أكسدة - إختزال إلى نصفي تفاعل، في أحد نصفي التفاعل، تدعى المادة ذات درجة الأكسدة الأعلى المادة المؤكسدة ويرمز لها بالرمز Ox ، أما المادة التي درجة اكسدتها أقل فتدعى بالمادة المختزلة ( المرجعة ) Red.
تمثل الصيغة المؤكسدة والمختزلة زوجاً مترافقاً ولا يمكن لنصف التفاعل أن يحدث بدون النصف الآخر.
فإذا كان هناك منح للإلكترونات فلا بدّ من وجود مستقبلات , وفي الحقيقة يجري التفاعل الناتج من مجموع التفاعلين النصفيين السابقين بالشكل التالي :
Ox1 + Red2 ⇌ Red1 + Ox2
وبالتالي يجب أن يكون عدد الإلكترونات المقدمة مساوياً لعدد الإلكترونات المكتسبة
خصائص الأكسدة - إختزال
تختلف خاصية منح الإلكترونات واستقبالها باختلاف طبيعة المادة. ولتحديد هذه الخاصة لابدّ من استخدام ثوابت التوازن للتفاعلات التالية :
حيث تمثل αe فعالية الإلكترونات المتناوبة.
- وبما أننا لا نستطيع فصل نصف التفاعل الأول عن الثاني بالتالي لا يمكن تحديد كل من K°1 و K°2 وبالتالي يأخذ الثابت K°3 قيمة حقيقية بشكل تام.
- من الواضح أن هناك تشابه كبير بين تفاعلات أكسدة - إختزال وتفاعلات حمض - قاعدة وذلك من حيث انتقال الإلكترون في حالة تفاعلات أكسدة - إختزال وانتقال البروتون في حالة حمض - أساس (قاعدة).
- يوضح ثابت التوازن الكلي القوة النسبية للمؤكسد أو المرجع وذلك عند تقدير قوة الحمض أو الأساس.
- ويستخدم بصورة أكثر دقة مفهوم الكمون للتعبير عن خاصية الأكسدة - الإرجاع.
- وهذا يرتبط بشذوذ خاصية الشكل الواحد للتفاعل. يمكن فصل تفاعل أكسدة - إختزال في الفراغ وذلك بسبب ظهور التيار الكهربائي عند نقل الإلكترونات ومن ثم تتحول الطاقة الكيميائية إلى طاقة كهربائية ولكن يحدث مثل هذا التحول في خلية تدعى الخلية الغلفانية.
الخلية الغلفانية
- لندرس التفاعل بين ³ ๋Fe و ¯I حيث يفصل بينهما غشاء من السيلوفان
2 2Fe ๋³ + 2I¯ ⇌ 2Fe ๋² + I
- يُلاحظ تحرر اليود الحر وذلك عند مزج محاليل كلوريد الحديد الثلاثي ويوديد البوتاسيوم ويستمر ذلك حتى حصول التوازن.
ويمكن فصل هذا التفاعل إلى نصف تفاعل أولي ( أكسدة )
2I¯ - 2e ⇌ I2
ونصف تفاعل ثاني إختزال ( إرجاع )
2Fe ๋³ + 2e ⇌ 2Fe ๋²
يتم فصل نصفي التفاعل بوضع محلول FeCl3 في وعاء والمحلول KI في وعاء آخر نصل بين المحلولين بناقل معدني ( يجب أن تتصل كل من نهايتيه إلى خلية مستقلة من معدن البلاتين الخامل).
ويستخدم جسر ملحي من أجل غلق الدارة الكهربائية وهو عبارة عن أنبوب بشكل حرف U يملأ بمحلول مشبع من KCl وهو كهرليت ناقل للتيار الكهربائي.
- يجري تيار الإلكترونات في السلك الخارجي من ¯I إلى Fe ๋³ حيث يتحرر اليود في الوعاء الذي يحتوي KI طالما لم يتحقق التوازن.
- تسمح إمكانية الفصل الفراغي بين نصفي تفاعل أكسدة - إختزال ( إرجاع ) بتفسير هذه التفاعلات ليس بالاعتماد على ثابت التوازن وإنما على القوة المحركة الكهربائية للخلية الغلفانية التي تمثل فرق الكمون.
يعطى العمل الناتج من التحول الكهركيميائي لمول واحد من المادة بالعلاقة التالية :
A = nFE
حيث تمثل n عدد الإلكترونات
F ثابت فاراداي C /mol 10⁴ × 9.65
E القوة المحركة الكهربائية (emf) V.
من أجل التفاعل التلقائي السابق:
Ox1 + Red2 ⇌ Red1 + Ox2
يساوي هذا العمل التغير في طاقة جيبس ويعاكسه بالإشارة أي أن :
A = – ΔG = nFE
تشير القيمة السالبة إلى تلقائية العملية وبما أن :
°ΔG = ΔG° + RT ln K
بالتالي :
بقلب لوغاريتم الكسر نجد :
ومن هذه العلاقة نجد :
وعندما تكون فعاليات جميع المكونات مساوية الواحد يصبح الحدّ الثاني مساوياً الصفر، ومن ثم نحصل على الكمون القياسي الذي يمثل خاصة أساسية للخلية الغلفانية :
E° = –ΔG° / nF
ويساوي هذا الكمون القياسي الفرق بين كمون أكسدة المادة المؤكسدة وكمون إختزال ( إرجاع ) المادة المرجعة :
E°Cell = E°Ox – E°Red
ويمكن قياسها مباشرة بوصل كل من المحلولين بمقياس فولت الذي ينحرف مؤشره إلى القيمة E°Cell بشرط أن تكون جميع فعاليات المواد الداخلة والناتجة مساوية الواحد.
يمكن من خلال قيمة E°Cell معرفة إذا كان التفاعل تلقائي تكون عندها E°Cell > 0
أم غير تلقائي تكون عندها E°Cell < 0.
يتم تحديد الكمون الإرجاعي لكل ثنائية كهربائية عن طريق المقارنة بكمون الإرجاع ( الأختزال ) لإحدى الثنائيات القياسية ( الكترود قياسي ). ويفضل القيام بهذه التقديرات عند شروط قياسية أي عند درجة حرارة محددة وضغط وفعاليات المكونات مساوية الواحد.
ولكن تجدر الإشارة إلى أنه ليس كل الكترود يمكن أن يكون الكترود قياسي حيث يجب أن يحقق نصف التفاعل مجموعة من الشروط :
- يجب أن يكون التفاعل عكوس
- أن يكون جهد الالكترود ثابتاً ومتكرراً
- أن يكون الالكترود بسيط التركيب
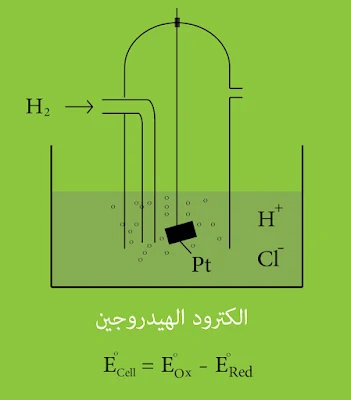
يستخدم من أجل ذلك الكترود الهيدروجين وهو عبارة عن وعاء مملوء بمحلول حمض كلور الماء أو حمض الكبريت بحيث يكون αH+ = 1، وتتدلى فيه صفيحة من البلاتين مغطاة بطبقة من مسحوق البلاتين الاسود , يمرر فيه الهيدروجين تحت ضغط 1atm كما هو موضح بالشكل التالي :
يعطى نصف التفاعل بالتوازن التالي :
2H ๋ + 2e ⇌ H2
ويكون كمون إرجاع (إختزال) ثنائية الهيدروجين مساوياً الصفر أي أن E° 2H ๋/H2 = 0 عند أي درجة حرارة.
يتم قياس كمون الإرجاع القياسي لالكترود ما عن طريق تشكيل خلية غلفانية مؤلفة من الكترود الهيدروجين القياسي والالكترود المراد قياس كمون إرجاعه القياسي حيث يستخدم محلول له αM+ =1.
يوصل الألكترودان بمقياس فولت الذي ينحرف مؤشره.
القوة المحركة الكهربائية للخلية:
E°Cell = E°Ox –E°Red
وهنا نمير حالتين :
1- للهيدروجين دور مؤكسد 2H ๋ + 2e¯ → H2
في هذه الحالة نجد أن:
2- للهيدروجين دور مرجع ๋H2 – 2e¯ → 2H
في هذه الحالة يكون :