ثوابت استقرارية المعقدات
إن تشكل المعقدات باستبدال مرتبطات أخرى بجزيئات ماء في الطبقة المُحلحلة للشرجبة المعدنية ( الذرة المركزية) وفي المحاليل المائية، يقود عادةً إلى توازن بين معقدين أو أكثر.
يحدث التفاعل على مراحل ويميز كل مرحلة ثابت توازن خاص بها ويبسط بشكل عام مفهوم تشكل المعقدات على أنه تفاعل بين شاردة معدنية وإحدى المرتبطات :
إن الثوابت K1 , K2........ Kn هي ثوابت الاستقرار المرحلي، لأن كل مرتبطة متساندة أصلا تدفع أو تزيح مرتبطة أخرى من النوع نفسه وتميل لأن تتثبت مكانها.
إن قيم الثوابت تتناقص وفق الترتيب التالي : K1 > K2 ......... > Kn
ثابت الاستقرار الكلي β للمعقد
ليكن لدينا على سبيل المثال ما يلي :
إن جداء ثوابت الاستقرار المرحلي يعطي ثابت الاستقرار الكلي β :
يستعمل عادةً الرمز pβ أي log β لقياس استقرار أخر معقد.
فمثلاً يكون pβ للمعقد ๋ ²[ Cu(NH3)4]
مساوياً 13.2 = 2.3 + 3.0 + 3.6 + 4.3
أما pβ للمعقد ๋ ⁹[Cd (NH3)4] فيساوي 7.0، يُعد المعقد ثابتاً إذا تجاوزت قيمة pβ العدد 8
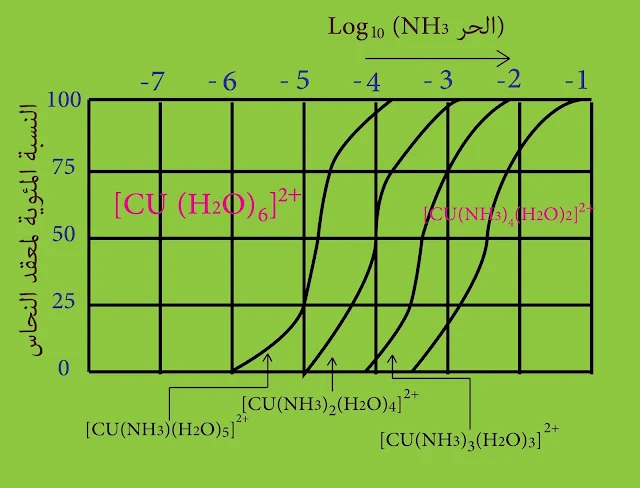
يبين الشكل التالي تغيرات نسب معقدات النحاس النشادرية المائية في المحلول المائي الحاوي تراكيز متغيرة من النشادر الحر
لتفسير ما يحدث وفق الشكل نفترض على سبيل المثال أن تراكيز النشادر ⁴¯10 mol/l فيحتوي عندها المحلول 5% من المعقد ๋ ²[ Cu(NH3)3 (H2O)3] و 45% من المعقد ๋ ²[ Cu(NH3)2 (H2O)4] و 40%من المعقد ๋ ²[Cu(NH3) (H2O)5]
و 10% من شوارد النحاس المميهة.
- تحسب عادةً ثوابت الاستقرار بدءاً من تراكيز الأشكال الموجودة في حالة توازن في المزيج الحاوي الشوارد المعدنية والمرتبطات بتراكيز متغيرة.
- تبقى معاملات الفعالية ثابتة باضافة كميات معتبرة من الملح
- عادةً يضاف فوق كلورات الصوديوم الذي لا تتفاعل شوارده مع الشرجبات المعدنية والمرتبطات
- تمدد منحيات التراكيز لأجل قوة شاردية معدومة.
- من المفيد إيجاد عدد جزيئات الماء المزاحة في كل مرحلة، وليس من الضروري أن يكون مجموعها الكلي مكافئاً للعدد التساندي للشرجبة في المركب الصلب.
- في محل قطبي مثل الماء يمكن للمرتبطات أن لا تزيح كل جزيئات المُحل.
- يمكن التعبير عن توازن أحد المعقدات بين شرجبته ومرتبطاته بصورة أكثر بساطة مما سبق دون أن يوضع في الحسبان التميه وشحنة الشاردة :
M + nL ⇌ MLn
- يمكن للتركيز الكلي للمعدن في الشرجبات المُحلحلة وفي المعقد [M] وللتركيز الكلي للمرتبطة الحرة والمرتبطة في المعقد [L] أن تحدد بالتحليل الكيميائي .
- وتتعلق طريقة تحديد تركيز المعقد [MLn] بالجملة , عندما تتلون المرتبطة والمعقد أو عندما يمثلان امتصاصاً مميزاً خارج الطيف المرئي .
- تقاس الشدات الضوئية لأجل طول موجي محدد.
- لتحديد التناسب في التفاعل يمكن استخدام طريقة المتغيرات المستمرة لجوب Jop
حيث يعطي التركيز [MLn] بتابعية التناسب [L] + [M] / [M]
- في حالة الاستقرارية الضعيفة للمعقد فإن تشكله لن يكون تام، بتالي فإن قيمة β تتغير عندما تتغير نسبة التركيز في المعدن وفي العامل المساعد على تشكيل المعقد.
- لابد من معرفة معامل مشاركة الشاردة المعدنية أو المرتبطة بين المُحلين الغير منحلين وذلك في المشاركة لتحديد [M]
- وهكذا فإن النشادر الحر في حالة التوازن مع المعقد النشادري يحدد بدءاً من تركيز النشادر في طبقة الكلوروفورم في حالة التوازن مع المحلول المائي.
يعطى التوازن في حالة المرتبطة المانحة للبروتونات وفق التفاعل التالي :
๋ M +nHL ⇌ MLn +nH
ومنه فإن ثابت الاستقرار الكلي :
- يمكن الحصول على التراكيز في حالة التوازن بدءاً من قياس pH.
- طبعاً لا تطبق هذه الطريقة إلا عندما تكون L شرسبة حمض ضعيف
- ومن البديهي عدم تطبيق هذه الطريقة عندما تكون المرتبطة شاردة كلور أو شاردة مشابهة لأن الحمض المرافق للمرتبطة يكون متشرداً تماماً قبل أن يتشكل المعقد.