نظرية رابطة التكافؤ
قدمت نظرية باولينغ خدمة جُلى لتفسير بنية المعقدات بصورة كيفية وسهلة , وكذلك الخصائص المغناطيسية لهذه المعقدات. ولكن للحصول على نتائج كمية ينبغي استخدام حسابات معقدة جداً حيث تدخل في الحسبان صيغ الطنين بأعداد مرتفعة تتوافق والنظريات الثلاث :
- نظرية رابطة التكافؤ
- نظرية الحقل البلوري
- نظرية المدارات الجزيئية.
سوف نبين أولاً مبدأ نظرية رابطة التكافؤ لأجل شوارد معقدات العناصر الانتقالية.
مبدأ نظرية رابطة التكافؤ
- بدايةً في حالة المركبات البسيطة فإن نظرية رابطة التكافؤ تفترض تداخل المدارات سواءً كانت ذرية أو هجينة مع بعضها حتى تتشكل الرابطة.
- لكن في حالة المعقدات بشكل عام يحصل تداخل بين مدار من مرتبطة يحوي زوج إلكتروني ( أساس لويس ) مع مدار فارغ من الذرة المركزية ( حمض لويس )
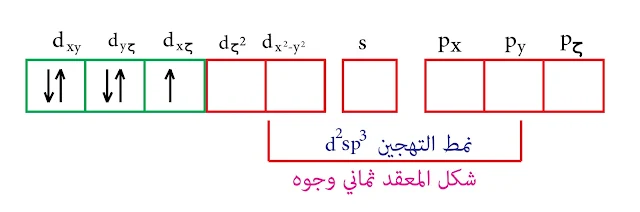
- وفق نظرية رابطة التكافؤ فإن مدارات الذرة المركزية تكون قطعاً هجينة أي بالوضع الهجين ويكون نمط التهجين حسب صيغة المعقد ( أي العدد التساندي للمعقد).
- أما المرتبطات هي أزواج إلكترونية على المدارات وهذه المدارات , إما أن تكون ذرية مثل الشوارد البسيطة السالبة ¯Cl و ¯F , أو أن يكون المدار هجين مثل NH3 أو H2O وفي هذه الحالة يكون الزوج الإلكتروني موجه نحو الارتباط ( المدار الفارغ في الذرة المركزية) بالتالي هذه المعقدات يفترض أن تكون أكثر ثباتاً من غيرها.
- إذاً بشكل عام افترضت نظرية رابطة التكافؤ حدوث تداخل بين مدارات الذرة المركزية مع المدارات الموجهة للمرتبطات , حيث تكون مدارات الذرة المركزية بنفس السوية الطاقية لذلك يجب حصول تهجين لهذه المدارات ومن ثمَّ يحدث التداخل مع مدارات المرتبطات.
تطبيق نظرية رابطة التكافؤ على العناصر الانتقالية
1- السكانديوم Sc
تكافؤه ثلاثي +3 و المدارات d فارغة بالتالي نكون أمام حالتين :
1- في حالة كان العدد التساندي 4
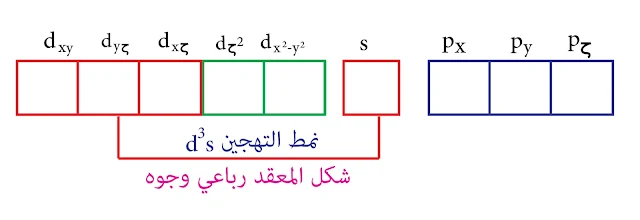
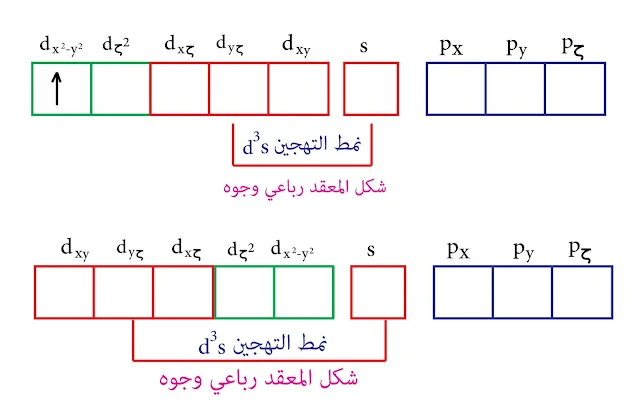
بالتالي نمط التهجين d³s و المدارات d الداخلة في عملية التهجين هي (dyζ , dxζ , dxy ) وهذه المدارات الثلاث متشابهة وتقع بين المحاور والشكل الناتج هو رباعي وجوه
ملاحظة : من الخطأ أن نقول أن نمط التهجين sp³ يمكنك عزيزي القارئ الأطلاع على التهجين من هنا
2- في حالة كان العدد التساندي 6
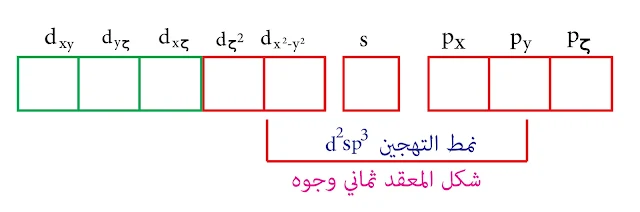
بالتالي نمط التهجين d²sp³ و المدارات d الداخلة في عملية التهجين هي (dζ² , dx²-y² ) وهذه المدارات تقع على المحاور والشكل الناتج هو ثماني وجوه.
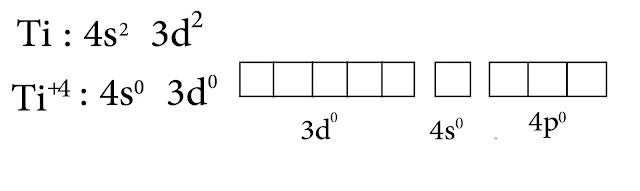
2- التيتانيوم Ti
تكافؤه رباعي +4 وبالتالي المدارات d فارغة.
1- في حالة العدد التساندي 4
نمط التهجين d³s والشكل رباعي وجوه
2- في حالة العدد التساندي 6
نمط التهجين d²sp³ والشكل ثماني وجوه
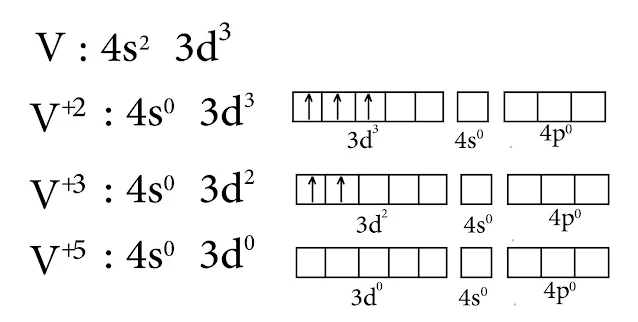
3- الفاناديوم V
الفاناديوم يأخذ التكافؤات التالية : 2+ , 3+ , 5+
هنا يجب ملاحظة أمر هام جداً :
كلما ارتفع تكافؤ العنصر يكون الميل أكثر إلى عدد تساندي منخفض وذلك لأن حجم الذرة يقل وبالتالي عدد المرتبطات حولها يقل.
ملاحظة أخرى :
العنصر الذي يمتلك عدّة درجات أكسدة يميل إلى الخواص القلوية ( قاعدية ) بدرجات الأكسدة الدنيا وإلى الخواص الحمضية بدرجات الأكسدة العليا ( اي تشكيل شوارد سالبة ¯Xo4 )
1- في حالة الفاناديوم الثنائي +V²
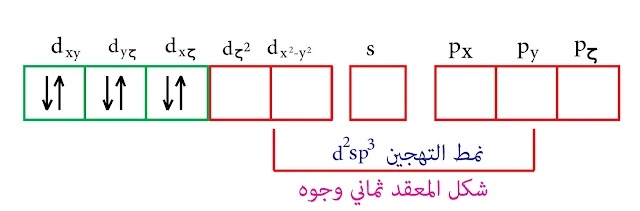
التكافؤ منخفض وبالتالي حجم الذرة كبير مما يزيد من عدد المرتبطات حولها بالتالي سيكون الميل نحو عدد تساندي مرتفع وهو في هذه الحالة 6 إذاً نمط التهجين d²sp³ , والشكل ثماني وجوه
إن مدارات d الداخلة في عملية التهجين هي (dζ² و dx²-y² ) وهذه المدارات تكون على المحاور.
2- في حالة الفاناديوم الخماسي
في درجات الأكسدة العليا لا يجوز كتابة V ๋⁵ وإنما VO³¯4 أو ¯VO3 , بالتالي يكون لدينا مدارات d فارغة وبدرجات الأكسدة العليا هناك ميل إلى عدد تساندي أقل.
وبالتالي عدد التساندي في حالة الفاناديوم الخماسي هو 4 والتهجين من النمط d³s والشكل رباعي وجوه
4- الكروم Cr
لديه درجتي أكسدة 3+ و 6+
1- في حالة درجة الأكسدة الدنيا (الكروم الثلاثي +Cr³)
يميل العنصر إلى عدد تساندي أكبر أي عدد مرتبطات أكبر. بالتالي في حالة +Cr³ يكون العدد التساندي 6 والتهجين من النمط d²sp³ ويكون الشكل ثماني وجوه
2- في حالة درجة الأكسدة العليا للكروم 6+ Cr
يميل العنصر إلى عدد تساندي أقل وبالتالي في حالة ²¯4 CrO ( الكروم السداسي)
(طبعاً لا يجوز أن نكتب 6+ Cr)
العدد التساندي هو 4 والتهجين من النمط d³s وذلك لأن مدارات d فارغة وهي أقل طاقة من 4p 
5- المنغنيز Mn
لهُ عدّة درجات أكسدة وهي 2+ , 4+ , 6+ , 7+
في حالة درجات الأكسدة الدنيا يكون العدد التساندي أكبر ما يمكن فهو في حالة المنغنيز الثنائي +Mn² يكون 6 والتهجين من النمط d²sp³ والشكل ثماني وجوه.
وهنا قدّ نسأل سؤال :
هل يمكن أن ينتقل إلكترون من طبقة إلى أخرى برابطة كيميائية؟
طبعاً الجواب لا
وذلك لأن طاقة الفرق بين سويتي الطبقتين تكون أكبر من طاقة الرابطة وبالتالي لا يتشكل تهجين من النمط sp³d² ذلك لأن عملية الانتقال إلى 4d غير مجدية وتعطي مركبات غير مستقرة.
وبالتالي في حالة +Mn² يتم تزاوج الالكترونات وتشكيل تهجين من النمط d²sp³ وهو ثماني وجوه.
ملاحظة :
نقول عن المركبات التي تمتلك درجات أكسدة عليا نتيجة لانتقال الالكترونات إلى طبقة أخرى وهي غير ثابتة بأنها مؤكسدات قوية لأن الكتروناتها سوفَ تعود وتتزاوج لتصبح بدرجات أكسدة أقل .
ففي حالة درجات الأكسدة (6+ , 7+ ) للمنغنيز يكون العدد التساندي 4 والتهجين من النمط d³s وهو يوافق شكل رباعي الوجوه.
6- الحديد Fe
يمتلك الحديد درجتي أكسدة (2+ , 3+ )
جميع معقدات الحديد الثنائي تمتلك عدد تساندي 6 والتهجين من النمط d²sp³ وبالتالي الشكل ثماني وجوه وهذا الأمر لا يتم إلّا بتزاوج الكترونات مدارات d.
ويتم التزاوج فقط في حالة المرتبطات القوية مثل ¯CN فهي قادرة على إجبار الكترونات مدارات 3d على التزاوج.
أما في حالة المرتبطات الضعيفة مثل H2O
فهي غير قادرة على أن تجبر مدارات d على التزاوج وبالتالي سيكون التهجين من النمط sp³d².
لكن هناك بعض الملاحظات :
- وجد أن جميع إلكترونات الحديد متزاوجة في حالة المرتبطات القوية وليس هناك الكترونات فردية إلا في حالات خاصة وعدد هذه الالكترونات الفردية هو (2)
- وجد أن طاقة ثبات المعقدات ثمانية الوجوه تتطابق مع التهجين d²sp³
- وجد أيضاً أن العزم المغناطيسي لم يشير إلى أيَّة الكترونات فردية في المحاليل المائية.
هذه الملاحظات كانت نقاط ضعف في نظرية رابطة التكافؤ.
أما في حالة الحديد الثلاثي يكون نمط التهجين d²sp³ والشكل ثماني الوجوه وذلك في حالة تزاوج الالكترونات
- في حالة الحديد الثلاثي يوجد إلكترون فردي واحد. ولكن وجد أن هناك حالات في الحديد الثلاثي يشير فيها العزم المغناطيسي إلى عدد الكترونات فردية أكثر من واحد.
وهذه أيضاً كانت من نقاط ضعف نظرية رابطة التكافؤ.
7- الكوبالت Co
يمتلك الكوبالت درجتي أكسدة (2+ , 3+ )
في حالة الكوبالت الثلاثي إذا كانت المرتبطات قوية سوفَ تجبر إلكترونات مدارات d على التزاوج وبالتالي يكون لدينا عدد تساندي 6 والتهجين من النمط d²sp³ والشكل ثماني الوجوه.
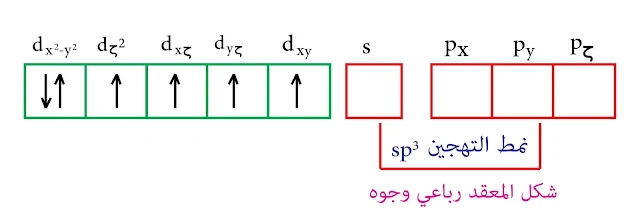
أما في حالة المرتبطات الضعيفة فهي غير قادرة على إجبار إلكترونات مدارات d على التزاوج عندئذٍ يكون العدد التساندي 4 والتهجين من النمط sp³ والشكل رباعي وجوه.
طبعاً التهجين sp³ وليس d³s والسبب في ذلك أن مدارات d ممتلئة بالالكترونات.
أما في حالة الكوبالت الثنائي يكون نفس الأمر مطبق في حالة المرتبطات القوية والضعيفة.
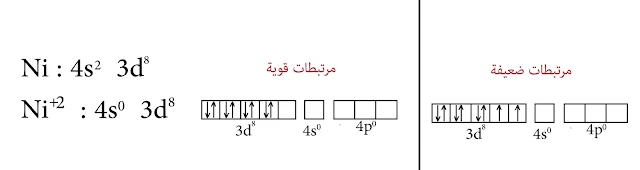
8- النيكل Ni
النيكل في معظم مركباته يأخذ درجة الأكسدة (2+ ) ودائماً النيكل يأخذ العدد التساندي 4 ولكن يكون لديه نوعين من التهجين.
الحالة الأولى :
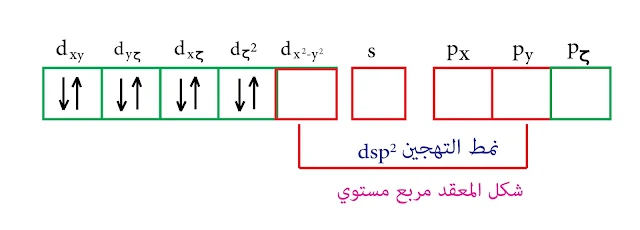
في حالة المرتبطات القوية تكون قادرة على إجبار الكترونات d على التزاوج وبالتالي يتشكل لدينا مدار واحد من d فارغ يدخل في عملية التهجين وبالتالي يكون التهجين من النمط dsp² والشكل رباعي مستوي
ملاحظة : مدار d الداخل في التهجين هو dx²-y² وليس dζ² ذلك لأن dx²-y² يقع في المستوي أما dζ² يكون عمودي على المستوي.
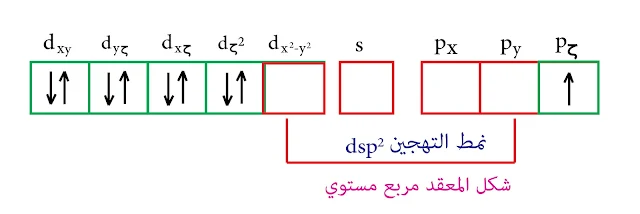
الحالة الثانية :
في حالة المرتبطات الضعيفة فهي غير قادرة على إجبار إلكترونات d على التزاوج وبالتالي التهجين من النمط sp³ والشكل رباعي الوجوه.
ملاحظة : التهجين من النمط sp³ حيث أنه لا يمكن تشكيل تهجين من النمط d³s أو من النمط dsp² وذلك لعدم وجود مدارات d فارغة.
سؤال ؟
ما هو الفرق بين الحالة الأولى والحالة الثانية؟
إن الفرق بين الحالة الأولى والثانية هو فقط في العزم المغناطيسي حيث أنه في الحالة الأولى لا يوجد الكترونات فردية وبالتالي تمتلك هذه المعقدات خواص ديا مغناطيسية حيث يكون العزم المغناطيسي = 0 مثال ذلك ²¯[4(Ni (CN]
أما في الحالة الثانية فيكون لدينا الكترونان فرديان وبالتالي تمتلك هذه المعقدات خواص بارا مغناطيسية وعليه يكون العزم المغناطيسي=2 مثال ذلك +²[4(3 Ni (NH]
9- النحاس Cu
يمكن لنحاس أن يأخذ التكافؤ الأحادي وذلك بالتخلص من الالكترون الموجود في 4s
إن المجموعة (+Cu+ , Au+ , Ag) عندما تكون أحادية التكافؤ يكونd¹⁰ ممتلئ ويكون العدد التساندي 2 والتهجين من النمط sp والشكل خطي ولكن بحالة خاصة يتحول العدد التساندي من ثنائي إلى ثلاثي ومنها إلى رباعي ومثال ذلك :
ولكن وجد أن أثبت معقد طاقياً هو ¯AgI2 اي العدد التساندي 2 وهو الأكثر استقراراً.
سؤال ؟
كيف نفسر أن طاقة الثبات الحراري تتناقص ورغم ذلك يتشكل المعقد؟
ذلك بسبب زيادة التركيز وبما أنه لدي توازن بالتالي ينزاح التوازن باتجاه تشكل المعقدات الأخرى.
أما في حالة النحاس الثنائي وجد أن النحاس هو رباعي مستوي بالبنية البلورية لمركباته المعقدة وجميعها رباعية مستوي أي التهجين من النمط dsp² ويفسر ذلك بانتقال الكترون من مدارات d إلى مدارات P ويتشكل التهجين dsp²
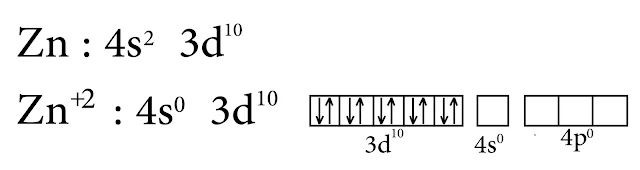
10- الزنك Zn
فوائد نظرية رابطة التكافؤ
- تم الاستفادة من نظرية رابطة التكافؤ في التعرف على الخواص المغناطيسية للمعقدات وذلك من خلال معرفة عدد الالكترونات الفردية في مدارات d
- بارا مغناطيسية وتكون عندها الالكترونات فردية
- ديا مغناطيسية وتكون عندها الالكترونات متزاوجة
- من خلال معرفة التهجين يمكن معرفة عدد الالكترونات الفردية ويمكن حساب العزم المغناطيسي والعكس صحيح أي بمعرفة العزم المغناطيسي يمكن معرفة عدد الالكترونات الفردية وبالتالي نمط التهجين والشكل الفراغي للمعقد.