التهجين المداري | تهجين المدارات الذرية
لمعرفة بنية المعقدات والروابط التي بها يجب أولاً معرفة بنية الذرة والإلكترونات التي تمتلكها هذه الذرة ويجب أيضاً معرفة البنية الإلكترونية وتوزع مستويات الطاقة ( S ' M' L ' N).
الذي يحدد مستوى الطاقة هو (n + L) وليسَ n وهذا ما يفسر أن مدار 4s يمتلئ قبل المدار 3d لأنه أخفض طاقة منه.
بعد ذلك يجب معرفة كيفية توزع الإلكترونات حيث تتوزع الإلكترونات وفق ثلاث مبادئ هي:
- مبدأ البناء
- قاعدة هوند
- مبدأ الاستبعاد لباولي
- وجميع هذه المبادئ تعتمد على مبدأ الطاقة
- يتوضع الإلكترون في مكان تكون طاقته فيه أقل ما يمكن أي يحقق الاستقرار
فمثلاً : قاعدة هوند تعتمد على أن عدد الإلكترونات الفردية في المدارات ذات الطاقة نفسها يجب أن يكون أكبر ما يمكن
مثال آخر : إذا كان لدّي إلكترونيين حتى يتوضع الإلكترون الثاني في s يجب أن يصرف طاقة المدار s بالإضافة إلى صرف طاقة التزواج أيضاً , وإذا توضع هذا الإلكترون الثاني على المدار p فإنه يصرف طاقة المدار p بالإضافة إلى طاقة المدار s
الآن إذا كان مجموع طاقة المدار s وطاقة التزاوج أقل من طاقة المدار s وطاقة المدار p فإن الإلكترون الثاني يتزاوج مع الإلكترون الأول في المدار s وذلك لأنه يحقق أقل طاقة وبالتالي أكثر استقرار.
أشكال المدارات الذرية
S : يمتلك مدار واحد موجه في الفراغ في كل الاتجاهات وشكله كروي
p : يمتلك ثلاث مدارات تقع على محاور الأحداثيات (x , y , ζ) وشكله مغزلي
d : يمتلك خمسة مدارات وهي نوعان :
1- ثلاث مدارات توجد في مستويات المحاور (x , y , ζ) وهي بين المحاور وليست على المحاور وهذه المدارات هي :
dxy : يقع في مستوي المحورين x , y
dxζ : يقع في مستوي المحورين x , ζ
dyζ : يقع في مستوي المحورين y , ζ
2- مداران يقعان على المحاور (x , y , ζ) وهذان المداران هما :
dx²-y² : يقع على المحاور (x , y)
dζ² : يقع على المحور (ζ)
ملاحظة : تم التوصل إلى أشكال هذه المدارات وذلك من خلال تحديد الكثافة الإلكترونية التي يمثلها (ψ²)
المدارات الهجينة
- إن المدارات الهجينة هي عبارة عن جمع خطي للمدارات ومن ثم تتهجن مع بعضها, يكون عدد المدارات الهجينة يساوي عدد المدارات الداخلة في التهجين
- المدارات الهجينة متشابهة تماماً في كل شيء حتى الطاقة ماعدا التوجه للإرتباط
للمدارات الهجينة أشكال نذكر منها :
sp و sp² و sp³
أولاً - المدار الهجين sp
- يدخل هنا في التهجين مدار من s مع مدار من p حيث نحصل على مدارين.
- أثناء تداخل المدارين ينتج مدارين إحداهما رابط والآخر مضاد للربط وهنا تكون الرابطة خطية.
إن هذا التمثيل يمثل المعنى الفيزيائي للمدار وذلك من خلال الكثافة الإلكترونية Ψ², حيث أن الرمز الموضح بالشكل التالي :
- يمثل أن الكثافة الإلكترونية تكون موجهة بإتجاه الإرتباط تماماً على محور الارتباط ومتناظرة حول هذا المحور , وتدعى هذه المدارات بالمدارات الموجهة أو الجاهزة للارتباط.
- ويكون لدينا وفق الرمز أذينين كبير (+) وصغير (-) والمعنى الفيزيائي لذلك أن الكثافة الالكترونية لجهة أكبر من الجهة الأخرى وهذا يعني أن الارتباط يكون بالاتجاه (+) اي ان الكثافة الالكترونية تتركز باتجاه الارتباط , بالتالي إذا كان هناك إحتمال تشكيل رابطة , بالتالي هناك استقطاب بالكثافة الالكترونية و (+) تتوجه نحو العنصر الذي سوفَ يرتبط معه وهذا يعني أن الكثافة الالكترونية للرابطة تكون في منتصف المسافة بين نواتي الذرتين.
ثانياً- المدار الهجين sp²
يتداخل هنا مدار من s مع مدارين من p ويتشكل لدينا ثلاث مدارات هجينة تتوضع على شكل مثلث مستوي والزوايا بينها 120
ثالثاً- المدار الهجين sp³
يتداخل هنا مدار من s مع ثلاثة مدارات من p ويتشكل لدينا أربعة مدارات هجينة تتوضع على رؤوس رباعي وجوه
ملاحظة :
إن التهجين sp و sp² و sp³ لا علاقة له بالالكترونات وإنما فقط بالمدارات , أي يمكن أن يتم التهجين على مدارات فارغة أو نصف ممتلئة أو ممتلئة.
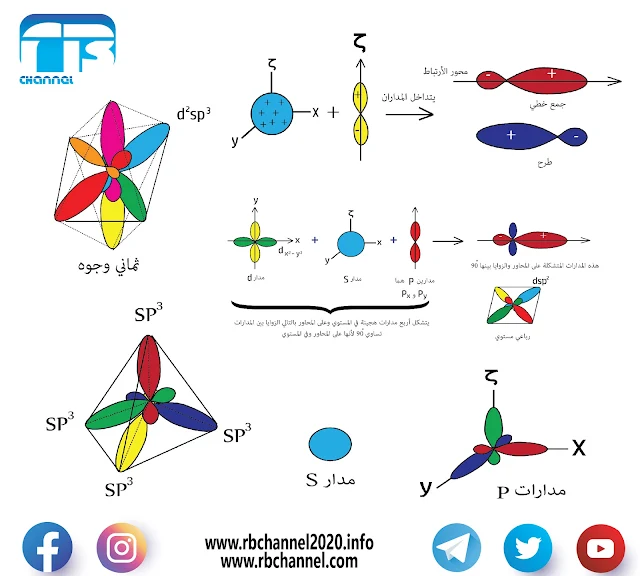
التهجين في المدارات d
لدينا ثلاث أنواع من مدارات d وهي :
(dx²-y² ) و (dζ² ) و (dxy , dxζ , dyζ )
1- إذا تداخل المدار dζ² مع مدار من مدارات p وليكن Pζ مثلاً سوفَ يعطي مدارين أحدهما ناتج عن الجمع الخطي +Ψ وهو رابط والآخر ناتج عن الطرح الخطي -Ψ وهو مضاد للربط.
ويكون نوع التهجين هو dp والرابطة خطية
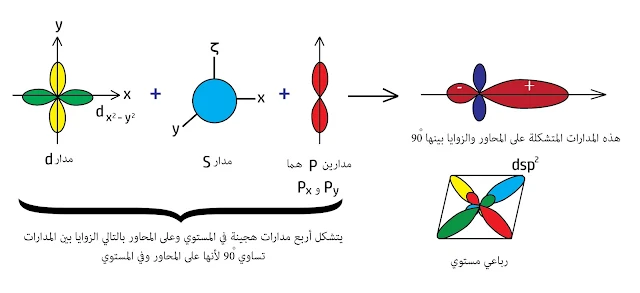
2- إذا دخل المدار dx²–y² في التهجين , عادةً عندما يدخل هذا المدار في التهجين نكون أمام حالتين :
- رباعي مستوي والتهجين عندها dsp²
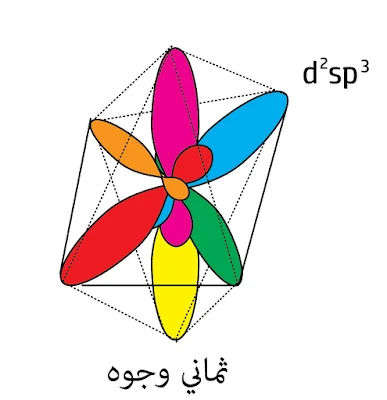
- ثماني وجوه والتهجين عندها d²sp³
ففي حالة النحاس هو رباعي مستوي والتهجين dsp² أي أنه يحصل تداخل مدار من s مع مدار من d وهذا المدار هو dx²–y² , يقع على المحاور في المستوي , وأيضاً مع مدارين من p يقعان على المحاور
أما التهجين d²sp³ هو عبارة عن تهجين dsp² (رباعي مستوي) مع dp (خطي عمودي) إذاً ستة مدارات تدخل في التهجين وبالتالي هو ثماني وجوه.
3- إذا دخلت مدارات (dxζ , dyζ , dxy ) في التهجين فإنها تدخل إما مع مدارات p ونمط التهجين عندها d³p , أو أنها تدخل مع مدارات s ونمط التهجين عندها d³s
هذه المدارات تكون بين المحاور وبالتالي لا ينتج إلا شكل وحيد وهو رباعي وجوه لأن رباعي الوجوه مداراته تقع بين المحاور.
ملاحظة :
- في حالة كان لدينا ثلاثة مدارات d فارغة بالتالي التهجين قطعاً d³s وليس sp³ وذلك لأن مدارات 3d أقل طاقة من 4p بالتالي دائماً يتشكل الأكثر استقراراً وهو الأخفض طاقة
- أما في حالة عدم تواجد ثلاثة مدارات d فارغة والشكل الناتج هو رباعي وجوه بالتالي التهجين من النمط sp³.
إذن لتحديد نمط التهجين وشكل المعقد يلزم معرفة البنية الالكترونية للطبقة التكافؤية للذرة المركزية في المعقد.
لنأخذ مثلاً عناصر الدور الرابع وهي :
Sc : ......... 4s² 3d¹ سكانديوم
Ti : ........... 4s² 3d² تيتانيوم
V : ......... 4s² 3d³ فاناديوم
Cr : ....... 4s¹ 3d⁵ كروم
Mn : ....... 4s² 3d⁵ منغنيز
Fe : ....... 4s² 3d⁶ الحديد
Co : ......... 4s² 3d⁷ كوبالت
Ni : ........ 4s² 3d⁸ نيكل
Cu : ........ 4s¹ 3d¹⁰ نحاس
Zn : ........ 4s² 3d¹⁰ زنك
إن القاعدة الأساسية تقول إن أول الإلكترونات التي تتشرد هي إلكترونات s بعدها تتشرد إلكترونات d
مثال : Fe² ๋ : ...... 4s⁰ 3d⁶
Fe³ ๋ : ........ 4s⁰ 3d⁵
ملاحظة :
عادةً الإلكترون يتشرد من الأخفض طاقة أي الأقل إرتباط , والسؤال هنا يقول :
بما أن s يمتلئ قبل d ألا يفترض أن تتشرد d أولاً ؟ إذاً كيف نفسر هذا الكلام
الجواب :
إن المستويات ns و d (n-1) تكون متقاربة تماماً في الطاقة بحيث يمكن أن تنخفض s وترتفع d أو ترتفع s وتنخفض d أي السويتين متداخلتان مع بعضهما ويعزى ذلك إلى البنية البلورية للمادة حتى إن إلكترونات d عندما تتشرد كمرحلة انتقالية تمر عبرّ مدارات s.