نظرية المدارات الجزيئية MOT
- لقدّ فسّرت نظرية رابطة التكافؤ العديد من المركبات لكنها كانت عاجزة عن تفسير العديد من المركبات التي تحتوي على الكترونات فردية مثل NO وغيرها.
- ففي جزيء الاكسجين يفترض أن تتشكل الجزيئة بتداخل المدارات الذرية التي تمتلك الكترونات فردية اي المدارات py و pζ من الذرة الأولى مع نفس المدارات من الذرة الثانية وبذلك نحصل على رابطة ثنائية O = O طبعاً إحداهما σ والأخرى π
- ويتشكل مدارين جزيئيين رابطين يحتوي كل منهما على زوج الكتروني رابط وبذلك لا تحتوي الجزيئة على الكترونات فردية وبالتالي هي تمتلك خواص ديا مغناطيسية.
- لكن في حقيقة الأمر هي بارا مغناطيسية وقيمة العزم المغناطيسي تُشير الى وجود الكترونيين فرديين على هذه الجزيئة لذلك عُدلت نظرية رابطة التكافؤ كي تفسر هذه الخاصة وسميت بنظرية المدارات الجزيئية.
وجدنا في نظرية رابطة التكافؤ أن تداخل مدارين يؤدي الى نشوء مدارين احداهما رابط +Ψ والثاني غير رابط –Ψ وحصلنا على هذين التابعين من دراسة حركة الكترون أو الكترونيين على مدار جزيئي.
في نظرية المدارات الجزيئية إذا كان هناك جزيئة مؤلفة من ذرتين A , B فإن حركة الالكترونات الرابطة توصف بتابع موجي ناتج عن الجمع الخطي للتابعيين الموجيين للذرتيين :
( Ψ = N ( a1 ΨA + a2 ΨB
N : ثابت التنظيم
a1 , a2 : ثابتين
يوجد هناك شكلين للتركيب الخطي للمدار الجزيئي الناتج +Ψ– , Ψ :
( Ψ+ = Na1,2 ( ΨA + ΨB
( Ψ– = Na1,2 ( ΨA + ΨB
طبعاً Na1,2 لأن 2 a1 = a
إن طاقة المدار الجزيئي +Ψ أصغر من طاقة المدارين الذريين ΨΑ , ΨΒ أما المدار الجزيئي –Ψ فطاقته أعلى.
يسمى فرق الطاقة بين متوسط الطاقة للمدارين الذريين وطاقة المدار الجزيئي +Ψ وهو المدار الرابط بطاقة الاستقرار ويرمز لها ΔΕ
أما فرق الطاقة بين متوسط الطاقة للمدارين الذريين وطاقة المدار الجزيئي –Ψ وهو المدار المضاد للارتباط تسمى بطاقة عدم الاستقرار ويرمز لها 'ΔΕ
ويمثل ذلك بيانياً بالشكل التالي :
نلاحظ أن +Ψ² الكثافة الالكترونية بين الذرتين في حالة المدار الرابط , بينما –Ψ² تكون معدومة بين الذرتين ووجود الكترون على هذا المستوى –Ψ يعطي الجزيئة عدم استقرار لأنه يعاكس الارتباط.
وفق نظرية المدارات الجزيئية يحدث التداخل على جميع المدارات الذرية المتواجدة في مستوى التكافؤ s و p وحتى d ولكن سنختصر الشرح هنا على مدارات s و p.
شكل المدارات الرابطة والمعاكسة للارتباط هي نفس الشكل في نظرية رابطة التكافؤ والفرق هنا هو أننا نتحدث عن مستويات طاقة لهذه المدارات من جهة ومن جهة أخرى هذه النظرية تأخذ جميع المدارات وليس المدارات التي فيها الكترونات الارتباط فقط.
1- التداخل بالنسبة لمدارات s
كما نعلم أن مدارات s تمثل فراغياً بالشكل الكروي والتدخل هنا يكون من النوع σ
لذلك نسمي المدار الرابط σs , والمدار المعاكس للارتباط *σs
2- التداخل بالنسبة لمدارات p
كما نعلم أن مدارات p تمثل فراغياً بالشكل المغزلي ويوجد لدينا في هذه الحالة نوعان من التداخل :
- تداخل رأس لرأس وينتج مدارات رابطة من النوع σ
- تداخل بطين لبطين وينتج مدارات رابطة من النوع π
لذلك سوف نحصل على ثلاث مدارات رابطة وثلاثة مدارات معاكسة للارتباط
- مدار من نوع σp يعاكسه *σp
- ومدارين من النوع π يعاكسه *π
في حالة المدارات الجزيئية يراعى تطبيق مبدأ البناء والاستبعاد لباولي وقاعدة هوند في ملئ المدارات حيث نبدأ من المدار الأخفض ثم الأعلى.
لنأخذ مثال عن الاكسجين :
نرسم أولاً المدارات الجزيئية
- نلاحظ وجود مدارين *σs و σs نوزع عليها الكترونات الموجودة على المدارات الذرية 2s لكلا الذرتين فتمتلئ بأربع الكترونات.
- أما في المدارات 2p فهناك ثمان الكترونات أربعة على كل مدار توزع هذه الالكترونات من الأخفض طاقة 2 الكترون في σp بعدها نوزع أربع الكترونات في المدارات π إذاً أصبح العدد 6 الكترونات موزعة وتبقى الكترونيين ليس لهما مكان في المدارات الرابطة لذلك تتوضع على المدارات المعاكسة للارتباط وحسب الطاقة الأخفض تتوضع على المدارات *π
- ولكن حسب قاعدة هوند يتوضع كل الكترون في مدار لذلك تُعدّ جزيئة الاكسجين ذات خواص بارا مغناطيسية بسبب وجود الكترونيين فرديين.
لكتابة البنية الالكترونية لجزيئة الاكسجين نضع رمز المدار و في أعلاه من جهة اليمين نضع عدد الالكترونات.
رتبة الرابطة
- تعادل رتبة الرابطة التكافؤ كما تعادل عدد الازواج الالكترونية الرابطة.
- يوجد هناك الكترونات على المدارات الرابطة والمدارات المعاكسة للارتباط
- الالكترونات الموجودة على المدارات المعاكسة للارتباط تلغي نفس العدد من المدارات الموجودة في المدارات الرابطة من حيث دورها في الارتباط لذلك نكتب العلاقة التي تعطي رتبة الرابطة أي عدد الروابط بالشكل التالي :
وفي مثالنا السابق عن الاكسجين تكون رتبة الرابطة.
رتبة الرابطة = ( 8 – 4) / 2 = 2.
إن الأشكال البيانية لمستويات طاقة المدارات الجزيئية للمعقدات تكون إلى حدٍ ما أكثر تعقيداً من الأشكال البيانية للجزيئات البسيطة ثنائية الذرات , لنأخذ الأشكال البيانية للشوارد المعقدة
+³[ 6(3 Co(NH] و ¯³[ 6 CoF]
- يُلاحظ في الجانب الأيسر من كل شكل المدارات الذرية 3d , 4s , 4p لشاردة الكوبالت (lll)Co اما المدارات الذرية ذات الطاقة الأعلى والادنى فلا تهمنا.
- كما يُلاحظ في الجانب الأيمن من كل شكل مستوى واحد للطاقة وهو الذي يشارك في تشكيل الروابط σ ، وذلك لأن المرتبطات الستة متساوية وكل مستوى للطاقة يوافق طاقة المدار لكل مرتبطة.
- إن طاقة مدارات المرتبطة بشكل عام أقل من طاقة مدارات المعدن ، لهذا تكون الروابط ذات طبيعة شاردية.
- وبالتالي المدارات الجزيئية الرابطة تكون أكثر تشابهاً مع مدارات المرتبطات منها مع مدارات المعدن ، وانتقال الكترونات المعدن الى هذه المدارات الجزيئية يؤدي إلى انتقال الشحنة من المعدن الى المرتبطة.
لنحاول الآن شرح ما يحصل وفق الشكلين السابقين
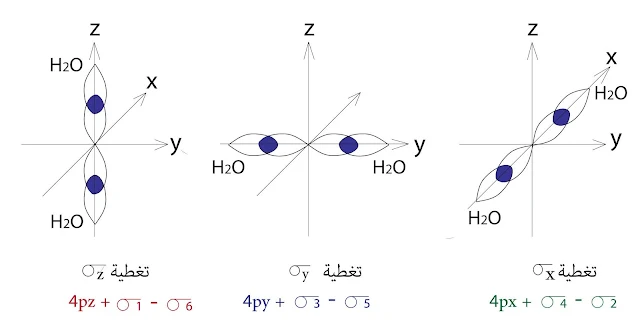
يتجه مداران من المدارات d وهما المداران dx²-y² و dζ² ( وهما مدارات eg ) ومدار 4s وثلاثة مدارات p باتجاه المحاور x , y , ζ
التي تتوضع عليها المرتبطات ، لهذا يؤدي تغطية مدارات المعدن والمرتبطات لتشكيل ستة مدارات جزيئية رابطة وستة مدارات جزيئية معاكسة للربط :
- (3)σd (2) σs (1) σp ستة مدارات رابطة
- (3)*σd* (2) σs* (1) σp ستة معاكسة للربط
تبقى لدينا ثلاثة مدارات من d وهي :
- dxy , dxζ , dyζ وهي تمثل مدارات t2g فلا تتجه باتجاه مدارات المرتبطات ، وبالتالي هي لا تشارك في تشكيل الروابط σ وطاقتها لا تتغير وتدعى بالمدارات غير الرابطة.
- إذا وجدت الكترونات (lll)Co والكترونات المرتبطات على المدارات الجزيئية للمعقد عندئذ ستمتلئ المدارات الرابطة الستة ، وهذا يوافق ستة روابط معدن – مرتبطة، أما الالكترونات الباقية ستتوزع بين المدارات غير الرابطة t2g والمدارات الجزيئية المعاكسة للربط *σd. والتي تنتج من تفاعلات مدارات المعدن dx²-y² , dζ² ومدارات المرتبطات.
- ولكن بما ان المدارات الجزيئية *σd قريبة بالطاقة لمدارات المعدن dx²-y² , dζ² فهي تتميز عنها بصورة غير ملحوظة ، لهذا نجد أن توزيع الزيادة من الالكترونات على t2g والمدارات الجزيئية المعاكسة للربط *σd يتم بصورة مشابهة لتوزيعها حسب نظرية الحقل البلوري مع عدد الالكترونات نفسها المتوضعة بين المداراتt2g و eg.
- وإذا كان الفرق في الطاقة Δο بين المدارات t2gغير الرابطة والمدارات الجزيئية *σd المعاكسة للربط قليلاً ، عندئذ تتحقق قاعدة هوند. ويظهر هذا الأمر في ¯³[ 6 CoF]
- حيث تتوزع فيه الالكترونات بالمدارات ⁴t2g و ²*σd ، كما أن وجود الكترونين على المدارات *σd يخفض عدد الالكترونات على المدارات الرابطة σd ومنه ينتج ضعف الرابطة Co — F.
- وإذا كان الفرق Δο كبيراً كما في المعقد +³[6(3 Co(NH] عندئذ فإن جميع الالكترونات تحرص على ملئ المدارات t2g
ملاحظة :
إن سبب تقسيم الطاقة بين المدارات t2g و eg و *σd مختلف في كلتا النظريتين.
فاستناداً إلى نظرية الحقل البلوري يعتبر الإنشطار نتيجة للتدافع الكهرستاتيكي بين الالكترونات d والمرتبطات.
أما الانشطار في نظرية المدارات الجزيئية فينتج من تشكل الرابطة المشتركة، حيث نجد أنه كلما كانت التغطية بين مدارات المعدن eg مع مدارات المرتبطات أكبر كلما كانت طاقة المدارات *σd أكبر.
بعض الأمثلة وفق نظرية المدارات الجزيئية
بعض الأمثلة وفق نظرية المدارات الجزيئية
1- التساند ثماني الوجوه
- خمسة مدارات 3d
- مدار 4s
- ثلاثة مدارات 4p
- يبين مخطط الطاقة هذا وجود ثلاث مجموعات للمدارات الجزيئية الرابطة وهي:
- وثلاث مجموعات للمدارات الجزيئية المضادة للربط وهي :
- ويوجد بينها ثلاث مدارات غير رابطة وهي :
2- التساند رباعي مستوي
- تم جمع مدارات σ الرابطة بسوية واحدة وكذلك المدارات π
- يبين مخطط الطاقات النسبية توضع المدارات الجزيئية σ و π بالقرب من مدارات المرتبطات لشوارد ¯Cl.
- أما المدار π*xy فإنه يتوضع فوق المدارات المضادة للربط π*yζ,xζ وذلك بفعل التأثير المتبادل بين 5dxy والمرتبطات الأربعة.
- كما أن المدار σ*ζ² المضاد للربط فيتوضع بين π*xy و π*yζ,xζ.
- إن الأمر المميز لسويات الطاقة في المعقد مربع المستوي هو السوية d التي تتمتع بطاقة مرتفعة جداً ، حيث نلاحظ أن سويات المدارات الجزيئية المضادة للربط وهي أربعة مدارات *σ و *π ذات طاقة مرتفعة متوضعة في وسط مخطط الطاقة وبالقرب من السويات الخمس الذرية 5d للمعدن .
- بما ان شاردة البلاتين الثنائية تتمتع بالتشكيل الالكتروني 5d8 ، ومرتبطات الكلور الأربعة تقدم 8 الكترونات σ و 16 الكترون π ، فيوجد إذا 32 إلكترون يتم توزيعها وفق المخطط السابق وبالتالي تكون الحالة الأساسية للمعقد ²¯[PtCl4] هي :








![الأشكال البيانية للمعقد +³[ 6(3 Co(NH] و ¯³[ 6 CoF] الأشكال البيانية للمعقد +³[ 6(3 Co(NH] و ¯³[ 6 CoF]](https://blogger.googleusercontent.com/img/b/R29vZ2xl/AVvXsEh69X9LR4eAopxUGZA-brHOre-LzK93IJAQpYOdmM64np-7T6gD_0m9SmXzHwD9gSsJjIYPWH9fhgCz4PRaKMWEXzEG5ai7s-W9Jx7OONBHKBPyZ5qtOtaUDtyvNuC5z3wB3mOZe0O3z7U/w640-h490-rw/7-0%25D9%25A1.jpg)


![مخطط الطاقات النسبية للمدارات الجزيئية للمعقد +³[Ti(H2O)6] مخطط الطاقات النسبية للمدارات الجزيئية للمعقد +³[Ti(H2O)6]](https://blogger.googleusercontent.com/img/b/R29vZ2xl/AVvXsEiW1F94nestx9XM8IRJ9lpG4k5Pj8PeFEEQlJsjc-hq-vUiep4FJnU-OSlHPmDPHeyrmFQ8ZYA2CWbskBQACCHry-braQJnRq_LmlVaVTsqqI3DzM3MHYJPTa7VdXBtROCV6TkinTmBc6U/w640-h640-rw/04-0%25D9%25A1.jpg)
![مخطط الطاقات النسبية للمدارات الجزيئية للمعقد ²¯[PtCl4] مخطط الطاقات النسبية للمدارات الجزيئية للمعقد ²¯[PtCl4]](https://blogger.googleusercontent.com/img/b/R29vZ2xl/AVvXsEgvCav6KsD0yU-p0ze4RDzZ4EbdH9b8gkGPoo6mlvt5B2DbQB5LdwSyHi6TYuwftzascelLAcqVnnT3inYjf-p4UiXSDv2oqTTaNjIPn9JZn6QSsBB76y_Yq0z6ywmp1fxbUSA7uwGOmTk/w640-h506-rw/05-0%25D9%25A1.jpg)