الهاليدات العضوية | التسمية - التصنيف - الخصائص الفيزيائية
تسمى الفحوم الهيدروجينية التي استبدلت فيها ذرة هيدروجين أو أكثر بنفس العدد من ذرات ( فلور - كلور - بروم - يود) بالهاليدات العضوية Organic Halides.
وفي بعض الحالات يمكن عملياً استبدال جميع ذرات الهيدروجين في الفحم الهيدروجيني بذرات هالوجين.
تصنيف الهاليدات العضوية
تصنف الهاليدات العضوية إلى :
1- هاليدات الكيلية
حيث تتصل فيها ذرة الهالوجين بمجموعة الكيلية وتمثل بصيغة العامة R-X حيث X تدل على ذرة الهالوجين.
2- هاليدات عطرية ( أروماتية)
حيث تتصل فيها ذرة الهالوجين بمجموعة أريلية وتمثل بصيغة العامة Ar-X حيث Ar يمثل جذر الأريل أو الجذر العطري المرتبط مباشرةً بالهالوجين.
- تُعد الهاليدات العضوية من المركبات واسعة الإنتشار والاستعمال في الوقت الحالي وقد كُشف عن عدد منها في بعض الكائنات الحية مثل الأسفنج والرخويات وكائنات بحرية أخرى .
- ويمكن تحضير بعض المركبات الهالوجينية مخبرياً. وهذه المركبات مهمة لأسباب عدة فهي كواشف هامة في عملية الأصطناع العضوي ويمكن أن تستخدم كمحاليل مثل الكلوروفورم CHCl3 ورابع كلوريد الكربون CCl4 أو مواد مطهرة مثل بروميد الميثيل CH3Br كما وتستخدم كمبيدات حشرية مثل سداسي كلورو بنزن و D.D.T أو مبيدات عشبية وفي إطفاء الحرائق حيث يستخدم رباعي كلوريد الكربون في الإطفاء غير أن تفاعله مع الاكسجين في الحرارة العالية يشكل غاز الفوسجين COCl2 الشديد السمية .
- كما وتستعمل في أجهزة التبريد حيث تستخدم مادة الفريون CCl2F2 للتبريد في معظم البرادات الكهربائية وتمتاز بعدم سميتها ومقاومتها للحرارة.
- كما واحتلت الهاليدات العضوية المحضرة من المشتقات البترولية مكانةً هامة نظراً لأستعمالها كمواد أولية في العديد من الصناعات البلاستيكية والمطاطية ومثال ذلك كلوريد الفينيل الذي يستخدم لتحضير بولي كلوريد الفينيل المعروف باسم PVC.
تسمية الهاليدات العضوية
تسمى الهاليدات العضوية وفق طريقتين :
1- تسمية الهاليدات وفق النمط الشائع
يقتصر على المشتقات البسيطة حيث يضاف اسم الهالوجين قبل الاسم الشائع للجذر الألكيلي إن كان الهالوجين هو المتبادل الوحيد ومن الأمثلة على ذلك نذكر
2- تسمية وفق قواعد IUPAC (نمط جنيف)
يؤخذ اسم السلسلة الرئيسية وهي أطول سلسلة تحوي رابطة ثنائية أو ثلاثية إن وجدت
ترقم السلسلة الرئيسية من الجهة الأقرب لأول متبادل بغض النظر إن كان جذراً ألكيلياً أو هالوجيناً.
في حال وجود أكثر من متبادل هالوجيني من نوع واحد يُرقم كل منها مع وضع كلمة ثنائي -di أو ثلاثي -tri أو رباعي -Tetra قبلها.
في حال وجود عدة أنواع من الهالوجينات المتبادلة يُرقم كل منها بحسب موقعه في السلسلة وترتب أسمائها بحسب الترتيب الهجائي اللاتيني.
إن أمكن ترقيم السلسلة من كلا الطرفين نختار الطرف الأقرب للمتبادل الأسبق بترتيب الهجائي اللاتيني سواءٌ أكان هالوجيناً أو ألكيلاً.
أنواع الهاليدات العضوية
1- هاليدات الميثيل
يستبدل فيها أحد هيدروجينات الميثان بالهالوجين
2- هاليدات الألكيل الأولية R-CH2-X
وهي المركبات التي ترتبط فيها ذرة الهالوجين X إلى ذرة كربون أولية
3- هاليدات الالكيل الثانوية R2-CH-X
وفيها ترتبط ذرة الهالوجين إلى ذرة كربون ثانوية
4- هاليدات الألكيل الثالثية R3-C-X
وفيها ترتبط ذرة الهالوجين إلى ذرة كربون ثالثية
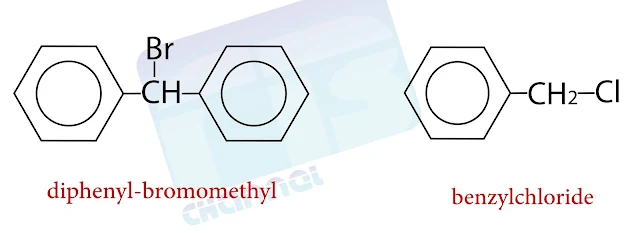
5- الهاليدات البنزيلية
وهي المشتقات التي لا ترتبط فيها ذرة الهالوجين بالحلقة مباشرةً بل ترتبط بذرة الكربون المرتبطة بالحلقة الأروماتية
6- الهاليدات الأروماتية
وفيها تكون ذرة الهالوجين مرتبطة مباشرةً مع الحلقة العطرية
نستخدم أحياناً بعض العبارات الخاصة لتحديد المواضع النسبية لمتبادلين هالوجينيين من نوع واحد وفي نفس السلسلة.
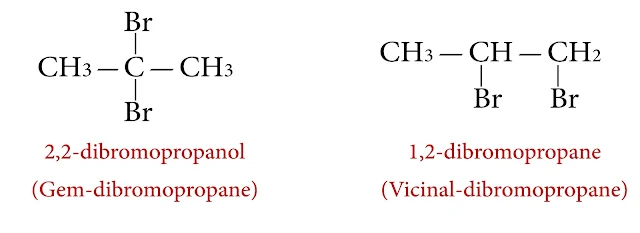
فكلمة توأمي Geminal تدل وجود ذرتي هالوجين على ذرة كربون واحدة
وكلمة تجاوري Vicinal تدل على وجود ذرتي هالوجين على ذرتي كربون متجاورتين
يضاف كلمة بير الى المشتقات الهالوجينية التي استبدلت فيها جميع ذرات الهيدروجين بذرات هالوجين
وتستخدم أسماء شائعة لبعض مشتقات الميتان متعددة الهالوجين استخداما واسعا مثل :
الخواص الفيزيائية للهاليدات العضوية
- تكون الحدود الأولى من هذه المركبات في الشروط العادية عبارة عن غازات أو سوائل أما الحدود المتوسطة تكون سوائل والحدود العليا فهي سوائل أو مركبات صلبة.
- تتعلق الخواص الفيزيائية للمشتقات الهالوجينية بطبيعة الهالوجين.
- ففي حال احتوائها على مجموعات الكيلية تحوي العدد نفسه من ذرات الكربون تزداد درجة غليانها وفق الترتيب التالي :
مشتقاتI > مشتقاتBr > مشتقاتCl > مشتقاتF
- كما تتعلق كثافة هذه المركبات بطبيعة الهالوجين حيث تزداد كثافتها بالانتقال من المشتقات الفلورية إلى المشتقات اليودية.
- فالمشتقات الكلورية أخف من الماء حيث أن كثافة كلور الايثان 0.9L أما المشتقات البرومية واليودية فهي أثقل من الماء , حيث أن كثافة بروم الايثان 1.43 , وكثافة يود الايثان 2.28
- تمتلك الحدود الدنيا من هذه المركبات رائحة مميزة ولاتنحل في الماء ولكنها تنحل في الاغوال وبعض المُحلات العضوية.