تحضير الهاليدات العضوية Preparation of Organic Halides
المشتقات الهالوجينية نادرة الوجود في الطبيعة لذلك يتم الحصول عليها بالاصطناع باستخدام نوعين من التفاعلات هما تفاعلات التبادل وتفاعلات الضم
1- هلجنة الفحوم الهيدروجينية
تتفاعل الفحوم الهيدروجينية الأليفاتية مع الهالوجينات Br2 و Cl2 بوجود الأشعة فوق البنفسجية معطية مزيجاً من المشتقات الهالوجينية ويتم التفاعل بالآلية الجذرية.
تتم الهلجنة باستعمال الضغط ودرجات عالية من الحرارة وفق التفاعل العام التالي :
R-H + X2 ⟶ R-X + HX
مثال ذلك :
كما تستطيع الألكانات الحلقية الخماسية أو السداسية أن تتفاعل مع الكلور أو البروم بوجود الأشعة فوق البنفسجية بحسب الآلية الجذرية معطية مشتقات أحادية أو متعددة الهالوجين مثال ذلك :
ويمكن أن يستمر الاستبدال لكل ذرات الهيدروجين.
ملاحظة :
- يجري التفاعل بشدة كبيرة وغالباً يرافقه انفجار المادة وتفحمها عند تأثير الفلور، لذلك لا تستعمل هذه الطريقة لتحضير المشتقات الفلورية.
- يتفاعل الكلور بصورة أقل يليه البروم
- لا تحضر المشتقات اليودية بهذه الطريقة.
2- من الألكِنات
يمكن لذرة الهالوجين أن تحل محل ذرة الهيدروجين الموجودة في الموقع الآلليلي وذلك عند إجراء التفاعل بوجود الضوء والحرارة ويتم التفاعل بالآلية الجذرية
مثال ذلك :
3- هلجنة البنزن
يتفاعل البنزن مع الهالوجينات Cl2 و Br2 بوجود وسيط من حمض لويس مثل FeCl3 و AlCl3 معطياً هاليدات الأريل .
مثال ذلك :
ويمكن إدخال المجموعة CH2Cl- إلى الحلقة العطرية ويتم ذلك بتفاعل البنزن مع الفورم ألدهيد وحمض كلور الماء وبحضور كلور التوتياء وسيطاً
حيث يتم التفاعل وفق آلية الاستبدال الإلكتروفيلي العطري .
ومثال ذلك :
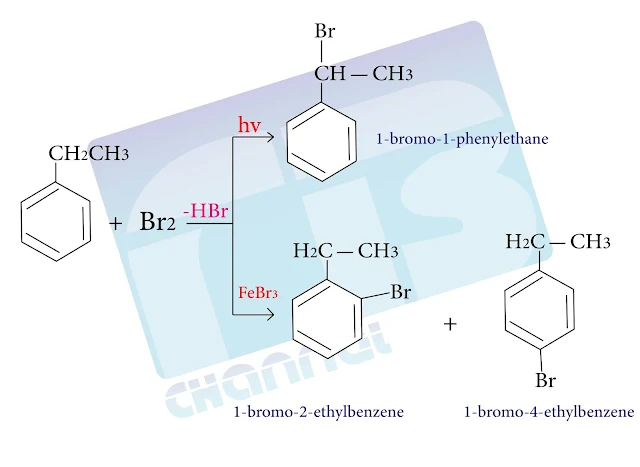
- ويمكن أن يتم التحضير من الكيلات البنزن التي تحتوي على جزء أليفاتي وجزء عطري
- حيث أننا نتوقع أن يخضع الجزء الأليفاتي ( السلسلة الألكيلية الجانبية) لتفاعلات استبدال جذرية وهي التفاعلات المميزة للألكانات وذلك بوجود الأشعة فوق البنفسجية التي تساعد على توليد الجذور الحرة ( ذرات الهالوجين)
- بينما يخضع الجزء العطري لتفاعلات الاستبدال الألكتروفيلي العطري وذلك بوجود وسيط من حمض لويس.
- ويتم التحكم في إدخال الهالوجين عن طريق أختيار الظروف المناسبة، فعند تفاعل البروم مع إيتيل البنزن بوجود الأشعة فوق البنفسجية يتم الاستبدال على السلسلة الجانبية أما في غياب الضوء وبوجود وسيط من FeBr3 فيتم الاستبدال على الحلقة العطرية
والتفاعل التالي يوضح ما سبق :
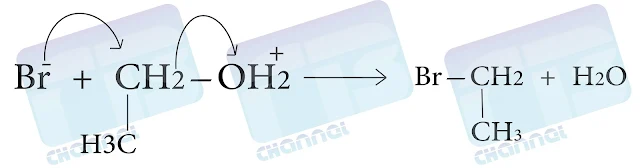
4- من الأغوال (الكحولات)
تتفاعل الأغوال مع HX لتعطي هاليدات الألكيل، حيث تتم برتبة الغول أولاً، ثم تهاجم شاردة الهاليد ذرة الكربون الفعالة وتفصل جزيئة الماء كمجموعة مغادرة جيدة
وتلعب بعض كلوريدات المعادن دوراً مزدوجاً إذ تساهم من جهة في نزع مجموعة الهيدروكسيل وتقدم من جهة أخرى شاردة الهاليد كنيكلوفيل لإعطاء هاليد الألكيل الموافق .
5- من المشتقات الهالوجينية
- يمكن استبدال هالوجين بآخر وذلك بتفاعل المشتقات الهالوجينية مع هاليدات المعادن، ويعتبر هذا التفاعل عكوس حيث يمكن إزاحته بأحد الأتجاهين عن طريق تغير تركيز شوارد الهالوجين.
- يستخدم هذا التفاعل عملياً للحصول على المشتقات اليودية و الفلورية.
- فمثلاً يمكن الحصول على المشتقات الفلورية من المشتقات الكلورية باستخدام فلوريد الانتموان وفق التفاعل التالي :
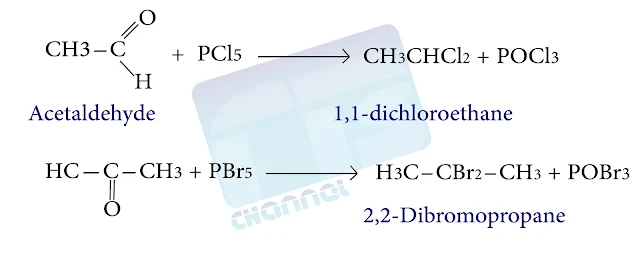
6- من الالدهيدات والكيتونات
يؤدي فعل هاليدات الفوسفور الخماسية على الألدهيدات والكيتونات إلى الحصول على مشتقات ثنائية الهالوجين التوأمية
كما في التفاعل التالي :
7- من الحموض الكربوكسيلية
تتحول الحموض الكربوكسيلية تحت تأثير PCl5 إلى كلوريدات الحموض ( مركبات كلور أستيل) والتي تعطي عند تسخينها تحت الضغط المشتقات ثلاثية الهالوجين
8- من الأمينات العطرية عن طريق تفكك أملاح الديازونيوم
يتفاعل الأمين العطري الأولي Ar-NH2 مع الحمض الآزوتي بوجود ( HCl أو H2SO4)
وبدرجة حرارة من 0 إلى 5 Cْ ويعطي ملح أريل الديازونيوم، والذي يعطي بتسخينه مع هاليد النحاسي CuX حيث (X=BrأوX=Cl) مركب هاليد الأريل وفق التفاعل التالي :
ويمكن تحضير المشتقات الفلورية بمعاملة محلول ملح الديازونيوم بالحمض HBr ثم تسخين ملح فلور بورات الديازونيوم الناتج ليتفكك ويعطي المشتق الفلوري العطري وثلاثي فلور البور وغاز الآزوت ويسمى هذا التفاعل بتفاعل شيمان Sechiemann