الايثرات Ethers | (الأنواع - الخواص الفيزيائية والكيميائية - التسمية - التحضير)
يعطي الاستبدال الالكيلي لذرتي هيدروجين في جزيء ماء بزمر الكيلية او بزمر عضوية أخرى مركبات تدعى الايثرات لها الصيغة العامة :
R-O-R
كما يمكن القول إن الايثرات ناتجة من الاغوال Alcohol( الكحولات) او الفينولات Phenols بالاستبدال ذرة هيدروجين في الزمرة الهيدروكسيلية بجذر الكيلي او اريلي.
انواع الايثرات:
يوجد نوعان من الايثرات
أولا- ايثرات متناظرة وفيها يكون R=Rَ
مثال : CH3OCH3
ثانيا - ايثرات غير متناظرة او مختلطة
وفيها يكون R لايساوي Rَ
مثال : CH3OC2H5
الخواص الفيزيائية والكيميائية
الخواص الفيزيائية للايثرات
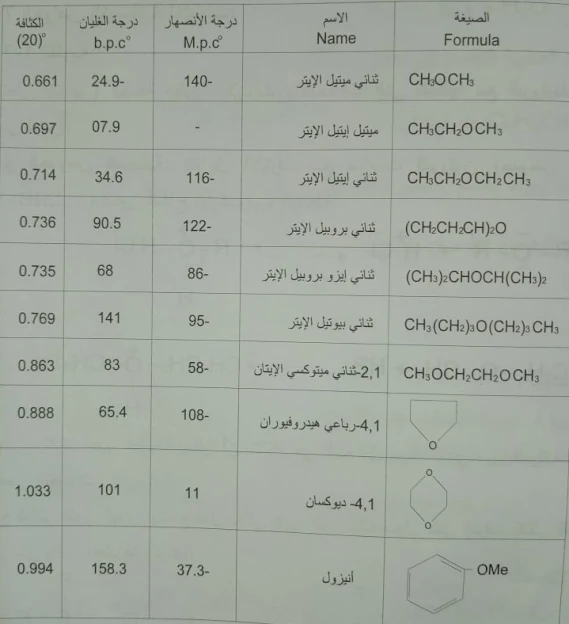
- تعتبر الايثرات مركبات عضوية تتصف بالخاصة القطبية الضعيفة ، كما أنها لا تستطيع الارتباط ببعضها بعضاً بجسور (روابط) هيدروجينية , لذلك من المتوقع أن تكون درجات غليانها أقل من الاغوال (الكحولات) وقريبة جداً من درجة غليان الالكانات المماثلة لها في الأوزان الجزيئية .
- تذوب الايترات جزئياً في الماء ، وخاصة تلك التي تتكون جزيئاتها من ذرات كربون قليلة ، ويرجع ذلك إلى إمكانية تكون روابط هيدروجينية بين هيدروجين الماء واكسجين الايثر.
- كثافة الايثرات أقل من كثافة الماء.
- تستخدم الايثرات كمذيبات لمعظم المركبات العضوية ، ويعد ثنائي ايتيل الايثر و THF من أكثر المذيبات العضوية الايثرية استخداماً في المختبرات الكيميائية .
وفيما يلي نرفق هذا الجدول الذي يوضح الخواص الفيزيائية لبعض الايثرات.
الخواص الكيميائية للايثرات
1- القلوية :
تظهر الصفة القلوية للايثرات بالاتحادات التي تشكلها مع البروتونات أو مع حموض لويس .
مع الحموض المعدنية : تتفاعل الايثرات مع مانحات البروتون ( وهي حموض قوية مثل HCl, HBr,....) لتكون املاح الاوكسونيوم المنحلة وفق التفاعل التالي :
وهي مركبات غير معزولة يمكن أن تتشكل في المحاليل حيث تؤدي دور المركبات الحفزية في بعض التفاعلات الكيميائية.
مع ثلاثي فلور البور: يسمح فعل ثلاثي فلور البور بالحصول على ايثرات ثلاثي فلور البور الثابتة التي يمكن تقطيرها وعزلها.
2- تحطيم أو فصم الايثرات Dissociation of ethers
يمكن فصم الروابط كربون - أكسجين في الايثرات بالحموض القوية والحرارة
حمض HI هو الحمض الوحيد القادر على التفاعل على البارد .
يعطي هذا الضم جزيء من الغول ( الكحول)
يتشكل من السلسلة الأطول
وجزيء من المشتق الهالوجيني ( يتشكل من السلسلة الأقصر)
مع زيادة كمية الحمض تتشكل المشتقات الهالوجينية دون الاغوال ( الكحولات).
أما الأيثرات العطرية تنفصم إلى هالوجين الالكيل وفينول .
يمكن أيضاً إجراء عملية الفصم بحمض لويس AlCl3 أو بهالوجينات الفوسفور
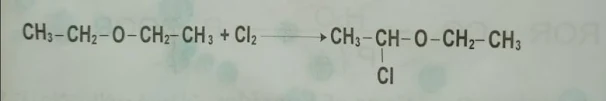
3- هلجنة الايثرات Ethers Halogenation :
يمكن كلورة أو برومة الايثرات على الكربون الفا بحضور فوق الاكاسيد المركب الوسطي في هذه التفاعلات هو جذر ثابت بالطنين .
4- أكسدة الأيثرات Oxidation of ethers :
الايثرات مركبات سريعة الاشتعال فهي تحترق بسهولة معطية لهباً مضيئاً.
ويؤدي فعل فوق المنغنات إلى فصم الجزيء وتشكل حمضين كربوكسيلين .
بإمكان الايثرات أن تثبت بدرجات الحرارة العادية، تتفاعل مع أكسجين الهواء تلقائياً لتعطي فوق الاكاسيد ( البيروكسيدات).
تزداد نسبة فوق الاكاسيد في الايثرات خلال التخزين أو عند التعرض للهواء أو الضوء وهذا ما يجعل تنقيتها قبل الاستخدام ضرورية في كثير من الاحيان .
5- حلمهة الأيثرات Hydrolyzate of ethers :
تتحلمه الايثرات في الماء وبدرجات حرارة مرتفعة 150C° لتعطي الاغوال ( الكحولات) أو الفينولات الموافقة .
كما يمكن أن تتفاعل الايثرات المتناظرة مع أحادي أكسيد الكربون عند درجة حرارة تتراوح ما بين 180-125C°وتحت ضغط جو بوجود BF3 كعامل مساعد. وكمية قليلة من الماء مكونة بذلك الاسترات وفق التفاعل التالي
تسمية الايثرات
<><>
تسمية الايثرات
تسمى الايثرات بأسماء مختلفة نذكر منها
التسمية الشائعة للأيثرات :
هي طريقة سهلة تعتمد على ذكر اسمي المجموعتين المتصلتين بذرة الأوكسجين وإتباع ذلك بكلمة إيثر.
تسمية الأيثرات وفق قواعد IUPAC :
تسمى الايثرات المعقدة وفق قواعد IUPAC بوصفها مشتقات الكوكسي Alkoxy حيث تسمى أكبر سلسلة كهيدروكربون اساسي يرتبط فيه جذر الكوكسي كمتبادل
مع ذكر المتبادلات الأخرى مسبوقة بأرقام توضح أماكن توضعها على السلسلة الكربونية.
وفيما يلي بعض الامثلة التي توضح التسميات الشائعة والنظامية :
كما توجد الايترات على شكل مركبات حلقية غير متجانسة وتسمى عندها اكاسيد وقد تضاف اللاحقة إيبوكسي Epoxy قبل الاسم
تسمية متعددات الايثرات :
مثال: CH3-O-CH2-CH2-O-CH3
هناك طريقتان لتسمية هذا النوع من الإيثرات والتي يطلق عليها متعددات الايثر
الطريقة الأولى :
إن الفحم الهيدروجيني الذي يأخذ اسم الايتر هو الموجود بين ذرتي الاكسجين فنرقمه ونذكر اسمه في نهاية التسمية.
ثم نضيف أسماء الجذور الصغيرة وفق ( الكوكسي أو أريلوكسي) مع ذكر رقم ذرة الكربون من الفحم الهيدروجيني التي يرتبط معها الجذر الصغير.
تستخدم هذه الطريقة في حال وجود ذرتين من الاكسجين فقط .
الطريقة الثانية :
نرقم السلسلة الخطية مع افتراض ذرات الاكسجين كما لو أنها ذرات كربون. ونذكر اسم الفحم الهيدروجيني المقابل في نهاية التسمية . نشير إلى الاكسجين في التسمية بكلمة ( أوكسا) وإذا كان لدينا تعدد في ذرات الاكسجين نذكر كلمة أوكسا مسبوقة بالمضاعفات ( دي - تري -.....) ونحدد موضع ذرات الاكسجين .
لنأخذ الان نفس المثال السابق
ملاحظة 1:
نشير إلى ذرة الاكسجين في متعددات الايثر الاوكسيدية الخطية وأحياناً الحلقية المشتقة من ثلاث جزيئات أو أكثر من المركبات الأليفاتية باللاحقة (أوكسا) ويحدد مواقع ذرات الاكسجين برقم ترتيبها بعد ترقيم السلسلة مع اعتبار ذرات الاكسجين كذرات كربون وذكر المضاعفات الملائمة لعدد ذرات الاكسجين ولكن يجب مراعاة قوة الوظائف .
وفيما يلي بعض الامثلة :
ملاحظة 2 :
إذا ارتبطت ذرة الاكسجين بِبُنيتين متطابقتين فيهما زمرة وظيفية منفصلة عن الزمرة الايثرية عندها يمكن الاشارة للزمرة الايثرية بكلمة ( أوكسي)
مثال ذلك:
ملاحظة 3:
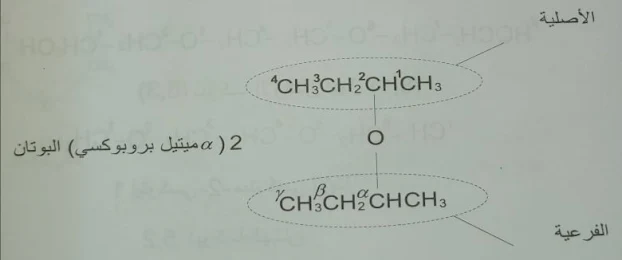
إذا كان لدينا سلسلة أصلية وأخرى فرعية وكانت السلسلة الفرعية تحوي فروع نقوم بما يلي:
1- نرقم السلسلة الأصلية الكبيرة بالأرقام (1-2-3......) ونكتب اسم الفحم الهيدروجيني الموافق له وهو الذي يعطي اسم الايثر النهائي .
2- نرقم السلسلة الفرعية بالأحرف اليونانية
( الفا - بيتا - غاما......) بحيث تكون ذرة الكربون في السلسلة الفرعية والتي تجاور ذرة الأكسجين هي الذرة الفا .
3- نسمي السلسلة الفرعية وفق ( الكوكسي أو اريلوكسي) مع الاشارة الى موقع المتبادلات في هذه السلسلة بالأحرف اليونانية وذكر أسمائها .
4- قبل اسم السلسلة الفرعية والمتبادلات التي تحويها نذكر رقم ذرة الكربون الأصلية التي ترتبط بالاكسجين كما نذكر المتبادلات الموجودة في السلسلة الأصلية وأرقام مواقعها قبل اسم السلسلة الفرعية والمتبادلات التي تحويها .
5- في حال كانت السلسلة الأصلية والفرعية متساويتان في عدد ذرات الكربون لايوجد عندها فرق في ترقيم اي منهما بالاحرف اليونانية مع مراعاة أن نبدأ بالحرف الفا من ذرة الكربون المجاورة للاكسجين في السلسة الفرعية وتكون كلتا التسميتين صحيحتين .
6- إن هذه الطريقة في تسمية الايترات اكثر استخداماً عند تسمية الايترات المهلجنة اي الايثرات الحاوية على ذرات هالوجين، حيث تعامل ذرات الهالوجين كمتبادلات سواء في السلسلة الأصلية أو السلسلة الفرعية .
وفيما يلي نرفق بعض الامثلة عن تسمية الايثرات المهلجنة الحاوية على ذرات الهالوجين ( الايثرات المهلجنة) :
تحضير الايثرات
<><>
تحضير الايثرات
توجد طرق مختلفة لتحضير الايترات نوضح أهمها فيما يلي :
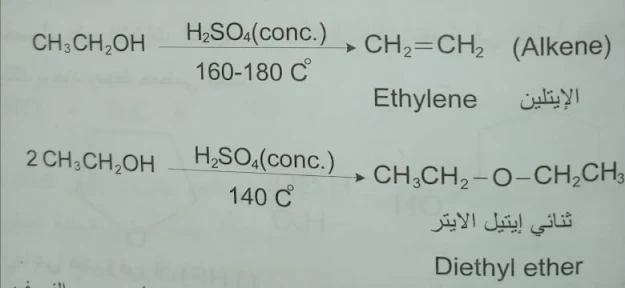
أولا- نزع الماء من الاغوال ( الكحولات) :
أن تسخين غول ( كحول) مع حمض قوي ينزع منه الماء ويحوله إلى ألكن ( Alkene)
وإذا عُدلت شروط التفاعل بحيث يتم التسخين عند درجة حرارة أقل ، فإن إزالة الماء تتم من جزيئتين ويتكون الايثر الموافق .
إن نزع الماء من الاغوال ( الكحولات) يتم باستخدام حمض الكبريت المركز أو حمض الفوسفور المركز أو بالتسخين مع وسيط Al2O3 وتعطي هذه الطريقة الايترات المتناظرة فقط .
(ملاحظة) إن هذه الطريقة محدودة الفائدة حيث يحدث فيها أحياناً تفاعلات منافسة تؤدي إلى تشكيل الالكِنات .
لاتنجح عادةً المحاولات التي تبذل لاستخدامها في تحضير ايثرات بها مجموعة الكيل ثانوية من اغوال ثانوية لأن الألكن يتكون بسهولة . أما محاولات تحضير ايثرات فيها مجموعة الكيل ثالثية فإنها تؤدي إلى تشكيل الألكن بصورة كلية .
يمكن تحضير الايثرات من الاغوال الأولية ذات الأوزان الجزيئية المنخفضة وذلك بتمرير بخارها على اوكسيد الألمنيوم
( Al2O3 الالومينا Alumina) المسخن إلى درجة حرارة (240-260درجة مئوية) وتحت الضغط .
لايمكن استعمال الفينولات بدلاً من الاغوال في تحضير الايثرات وفق التفاعل السابق بسبب حدوث عملية السلفنة (Sulphonation) في الحلقة البنزنية .
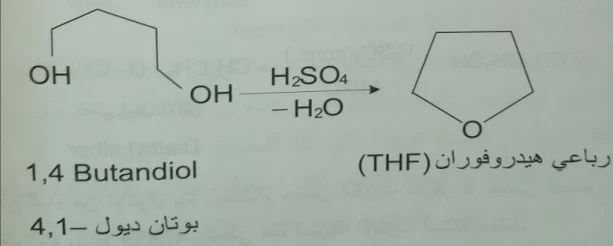
يُحضر الديوكسان ( مذيب عضوي هام ذواب في الماء والبنزن) بنزع الماء من جزيئي ايتيلين غليكول ( غول ثنائي الهيدروكسيل) عند معاملته بحموض لاعضوية
يتم الحصول على الايثرات الحلقية من الاغوال التي تتضم في بنيتها زمر هيدروكسيلية متباعدة وذلك بوجود وسيط حمضي أيضاً
ثانيا- اصطناع ويليامسون للايترات :
يُعد هذا الاصطناع من أفضل الطرق التقليدية المتبعة لتحضير الايثرات وخاصة المختلطة منها.
تتضمن هذه الطريقة تفاعل الكوكسيد الصوديوم أو فينات الصوديوم مع المشتقات الهالوجينية معطية الايترات ويدعى هذا التفاعل Williamson Synthesis.
يمكن استخدام هذا التفاعل عندما يكون Rَ مجموعة الكيل أولية أما إذا كان Rَ مجموعة ثانوية أو ثالثية فيكون مردود الايثر المتكون قليلاً، والسبب في ذلك يعود إلى كون مجموعة الالكوكسيد ( OR-) أساساً قوياً علاوة على كونها كاشفاً نوكليوفيلياً مما يؤدي إلى التحول من تفاعل استبدال نوكليوفيلي لتكوين الايتر إلى تفاعل حذف
( Elimination Reaction) يؤدي إلى تكوين مركب اوليفيني كناتج اساسي
من الممكن تحضير الايثرات العطرية بهذه الطريقة بتفاعل هاليدات الاريل الفعالة فقط مع الالكوكسيدات و الاريلوكسيدات، ويكون هاليد الالكيل فعالاً عندما تحتوي الحلقة العطرية على مجموعات ساحبة للالكترونات
قوية مثل مجموعة (NO2-) مستبدلة في الموقع اورتو أو بارا أو كليهما معاً
ثالثا- تحضير الايترات من ألكلة الاسترات اللاعضوية :
تستعمل هذه الطريقة لتحضير ميتيل الميتيل ( الايثرات الميتيلية CH3OR) ويتم ذلك بمعاملة كبريتات ثنائية الميتيل
( Dimethyl Sulphate) مع أيون الإلكوكسيد أو الفينوكسيد
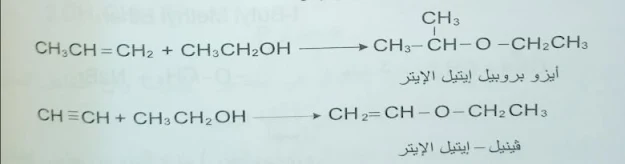
رابعا- يمكن الحصول على الايترات من تفاعل ضم الاغوال إلى الالكِنات أو الالكينات بوجود وسيط، ووفق قاعدة ماركونيكوف:
خامسا- يُحضر أكسيد الأيتيلين و الإيبوكسيدات بشكل عام من تفاعل فوق الحموض العضوية مع الألكِنات :
و يُحضر صناعياً بأكسدة الأتيلين بوجود الفضة كحفاز للتفاعل :
سادسا- تفاعل الاغوال أو الفينولات مع الديازوميتان:
تتفاعل الفينولات مع الديازوميتان لتعطي ايثرات بينما نجد أن الاغوال لا تتفاعل إلا بحضور وسيط من حمض لويس:
يعود السبب في ذلك إلى عدم امتلاك الاغوال حموضة كافية تمكنها من التفاعل بدون مساعدة وسيط .