الروابط الفيزيائية - الرابطة الهيدروجينية - قوى فاندر فالس
 |
| الروابط الفيزيائية - الرابطة الهيدروجينية - قوى فاندر فالس |
تحدثنا في مقال سابق عن الروابط الكيميائية وطرق تشكلها
وسنتابع في هذا المقال نوع آخر من الروابط وهو الرابطة الفيزيائية وأنواعها .
الرابطة الفيزيائية :
هي تلك الرابطة التي تنشأ بين الذرات أو الجزيئات أو بين ذرة وجزيء أو بين أيون و جزيء , ولا تؤدي الى حدوث تغير في الطبيعة الكيميائية للمادة من بين تلك الروابط الرابطة الهيدروجينية ورابطة فاندرفالس..
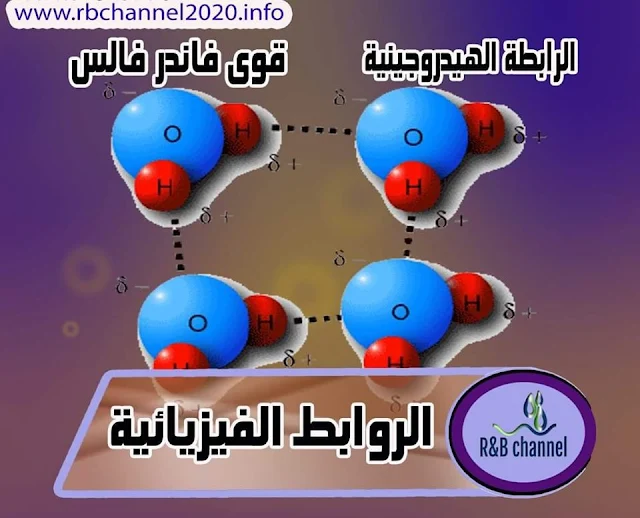
الرابطة الهيدروجينية :
- تنشأ الرابطة الهيدروجينية بين الجزيئات التي تحتوي على رابطة تساهمية قطبية , وبمعنى آخر بين جزيئات ثنائية القطب .
- حيث ترتبط ذرة الهيدروجين تساهمياً مع عنصر صغير جداً ذي كهرسلبية عالية مثل ( F - O - N ) , وتنتج جزيئات عالية القطبية تكون فيها ذرة الهيدروجين حاملة لشحنة موجبة .
- وبما أن النهاية الموجبة لثنائي القطب يمكنها الأقتراب من نهاية سالبة لثنائي قطب مجاور سيؤدي ذلك الى حدوث قوى تجاذب بين النهايتين .
- تدعى قوى التجاذب هذه برابطة الهيدروجينية .
- تحدث الرابطة الهيدروجينة بوجود ذرة الهيدروجين حصراً , وذلك لأن الذرات الأخرى لها أغلفة إلكترونية تحجب أنويتها عن هذا الأرتباط.
- كلما زادت عدد الروابط الهيدروجينة بين الجزيئات يزداد تجاذبها مع بعضها البعض وبالتالي تزداد درجة غليانها .
و NH3 درجة غليانه -33 cْ
السبب في ذلك هو عدد الروابط الهيدروجينة في الماء أكثر منها في النشادر .
ملاحظة : قد يسأل أحدهم لماذا لا تتشكل الرابطة الهيدروجينة بوجود ( Cl - Br - S ) برغم من أن كهرسلبية تلك الذرات عالية .
السبب في ذلك هو كبر حجم تلك الذرات حيث أن ذرة الهيدروجين صغيرة جداً وهذا الحجم يتناسب مع ذرات ( F - O - N ) الصغيرة أيضاً
( مثال ) : درجة غليان HF هي 17 cْ بينما درجة غليان HBr هي -70 cْ
والسبب في ذلك هو وجود الروابط الهيدروجينة في HF بينما لاتوجد تلك الروابط فيHBr.
والسبب في ذلك هو وجود الروابط الهيدروجينة في HF بينما لاتوجد تلك الروابط فيHBr.
الرابطة الهيدروجينة بين جزيئات الماء هي التي تجعله سائلاً في درجة حرارة الغرفة .
كما انها مسؤولة عن التحكم في توجيه جزيئات الماء في الجليد , بحيث يكون كل جزيء محاط بأربعة جزيئات أخرى من الماء مرتبطة مع بعضها بروابط هيدروجينة , ويؤدي ذلك الى إمتلاك الجليد لبنية مفتوحة وهذا ما يجعل الجليد أقل كثافة من الماء حيث يطفو فوقه .
قوى فاندرفالس :
تعتمد قوى فاندرفالس على ربط الجزيئات متعادلة الشحنة الغير قطبية بروابط فيزيائية ضعيفة جداً , ناتجة من تجاذب نوى الذرات في جزيء معين مع إلكترونات التكافؤ في جزيء أخر .
ونتيجة لهذا التجاذب يحدث أستقطاب في الجزيء المجاور ينشأ عنه عزم كهربائي صغير جداً .
وهذا العزم يولد عزوم مشابهة لهُ في الجزيئات المجاورة ولكن هذا التأثير لا يدوم طويلاً لأن الألكترونات في حالة حركة دائمة .
تتميز تلك القوى بأنها ضعيفة جداً يتلاشئ تأثيرها عند الأبتعاد عن الجزيء.
تتأثر قوى فاندرفالس بعدة عوامل :
1- حجم الجزيء
كلما زاد حجم الجزيء يصبح تشويه السحابة الألكترونية أسهل وهذا ما يفسر درجات غليان المواد المتشابهة
مثل SiH4 و CH4.. حيث أن جزيء SiH4 يمتلك درجات غليان أكبر من CH4
2- زيادة عدد الألكترونات في الجزيء
تساعد تلك الزيادة على إستقطاب السحابة الألكترونية وتشكيل عزوم كهربائية صغيرة تؤدي الى زيادة قوى فاندرفالس
( مثال ) ترتبط الهالوجينات برابطة فاندرفالس فا باالأنتقال من أعلى الفصيلة الى الأسفل ( من F الى I ) تزداد قوى فاندرفالس بسبب إزدياد العدد الذري
3- درجة الحرارة والضغط
كلما إنخفضت درجة الحرارة تستطيع قوى التجاذب التغلب على الحركة العشوائية للجزيئات .
كما أن زيادة الضغط يزيد عدد الجزيئات في وحدة الحجم وتسيطر قوى التجاذب الأمر الذي يساعد على تميع الغاز وتحويله الى سائل .
( مثال ) القوى بين ذرات الهيليوم ضعيفة من نوع فاندرفالس إلا أنه عند إنخفاض درجة الحرارة بصورة كافية فإن تلك القوى سوف تتغلب على الأثارة الحرارية مما يؤدي الى تكثف الهيليوم ....
