معايرات المعقدات Complexmetric titrations
- ماهي معايرات المعقدات ؟
- ماهي مادة ال Edta ؟
- التفاعلات المستخدمة في معايرات المعقدات
- مشعرات معايرات المعقدات
ماهي معايرات المعقدات ؟
تستخدم طرق المعايرة بتشكيل المعقدات على نطاق واسع في الكيمياء التحليلية ، حيث تعتمد هذه الطرق على تفاعلات ينجم عنها تشكل مركبات معقدة من تفاعل الأيونات المعدنية مع بعض المركبات الاخرى .
وبهذا تدعى المركبات الناتجة عن ارتباط الذرات او الايونات المعدنية بجزيئات أخرى بالمعقدات .
ومن أهم هذه المعقدات المعروفة بكثرة في التحليل الحجمي (المعقدات الامينية) التي تكون على شكل مشتقات الاحماض الأمينية المتعددة الكربوكسيل والتي تعرف تحت اسم مركبات الكومبلكسون ، واكثرها استعمالا الEdta .
ماهي مادة ال Edta ؟
هو إتيلن ثنائي أمين رباعي حمض الخل (Ethylen diamine tetra acetic acid) وله الصيغة الحمضية التالية :
ويرمز له اختصارا H4y وهو حمض رباعي الوظيفة الحمضية ، مما يدل على انه يتأين في محاليله المائية على اربعة مراحل لأعطاء Y-4 , ولكن الوظيفتين الحمضيتين الاولى والثانية قويتان نسبيا وتتأينان بشكل كامل ، غير ان الوظيفة الثالثة ضعيفة التأين ، اما الوظيفة الرابعة فهي ضعيفة جدا ، وبالتالي لايمكن أن تتأين إلا في الأوساط القلوية القوية .
وعمليا فإن مركب الEdta ضعيف الانحلال في الماء ، لذلك يتم استخدام ملحه الثنائي الأستبدال الصوديومي (اديتات الصوديوم) المنحل بشكل كبير في الماء Na2H2Y والذي يعرف في المراجع التحليلية تحت أسم التريلون ب (Trilon B) أو (الكومبلكسونIII )
وتمثل صيغته الجزيئية بالشكل التالي :
حيث يتأين في المحلول وفق المعادلة التالية :
+Na2H2Y → H2Y-2 + 2Na
أي ان جمبع مركبات الكومبلكسون هذه تحتوي على ذرات النتروجين N الامينية التي تستطيع ان تتساند مع بعض الايونات المعدنية بالإضافة إلى المجموعات الكربوكسيلية COOH التي يمكن ان تشكل روابط تكافؤية ولهذا يتفاعل الEdta مع الكثير من الكاتيونات مكونا مايسمى الاملاح المعقدة داخليا .
اكثر خواص المعقدات أهمية واستخداما في التحليل هي قدرتها على تكوين أملاح معقدة داخليا مع كاتيونات المعادن القلوية الترابية كالمغنزيوم والكالسيوم والباريوم التي من الصعب تحويلها إلى مركبات معقدة بوسائل أخرى ويمكن تمثيل صيغته المعقد الداخلي للكالسيوم بالصيغة الجزيئية التالية :
التفاعلات المستخدمة في معايرات المعقدات :
يوجد أربعة أنماط للتفاعلات المستخدمة في المعايرات القائمة على استخدام الEdta في معايرات تشكيل المعقدات :
1-تفاعلات التعقيد المباشرة :
يتم في هذه الحالة التفاعل مباشرة بين أيونات المعدن وأيونات الكومبلكسون (Edta) , كتفاعل أيون الزنك في المحلول الموقي الامونيومي أو أيونات الكالسيوم في وسط قلوي مع الEdta :
+Zn+2 + H2Y-2 —(NH4Cl + NH3)➡️ ZnY-2 +2H
وبما ان التفاعل مع الEdta يكون حساسا تجاه قيمة الph المحلول ، لذلك يجب أستعمال محاليل موقية أثناء المعايرة .
2- تفاعلات التعقيد غير المباشرة :
يتم في هذه الحالة التفاعل مابين محلول عياري من أيون معدني وبين الكمية الزائدة من الكومبلكسون .
حيث تتفاعل أيونات المعدن المدروسة مع كمية مكافئة لها من الكومبلكسون المضاف بكمية زائدة ، من ثم تتم معايرة الفائض من الكومبلكسون بمحلول قياسي لمادة قياسية كمحلول الزنك .
وكمثال على ذلك التفاعل المستخدم لتحديد الألمينيوم الذي يتم ضمن محلول موقي خلاتي عند ph=5
3- تفاعلات الإزاحة :
يتم هذا النمط من التفاعلات بين المحلول العياري لمعدن ما قادر على تحرير المعدن المراد تحديده من معقده المتشكل مع الكومبلكسون .
ومن ثم يتم تحديد المعدن المتحرر بمحلوى عياري من الEdta.
فمثلا تستطيع أيونات الباريوم إزاحة أيونات الزنك من معقدها مع الكومبلكسون ، لأن الباريوم يشكل معقدا أكثر ثباتا مع الكومبلكسون BaY-2 من معقد الزنك-كومبلكسون ZnY-2 وفق التفاعل التالي :
Ba+2 +ZnY-2 ➡️ BaY-2 + Zn+2
ومن ثم تتم معايرة أيونات الزنك المزاحة بواسطة محلول قياسي من الEdta بوجود مشعر الموركسيد .
4- تفاعلات المعايرات الحمضية - الأساسية :
ينتج من تفاعل أيونات المعدن M+ مع الكومبلكسون أيونات الهيدروجين وذلك وفقا للتفاعل التالي :
+M+2 + H2Y-2 ➡️ MY-2 + 2H
ويمكن بالتالي معايرة أيونات الهيدروجين المتحررة بمحلول عياري لأساس قوي وبوجود إحدى المشعرات الحمضية الأساسية :
2H+ + 2OH- ➡️ 2H2O
مشعرات معايرات المعقدات :
تكون بعض الأصبغة العضوية مع أيونات المعادن معقدات ملونة أقل ثباتا من المعقدات المتكونة مع الكومبلكسون Edta .
أي تحدد نقطة نهاية المعايرة عادة بإضافة مشعر يعطي لونا معينا مع الأيون المعدني التي تجري معايرته ، ولكنه يعود إلى لونه الأصلي عندما تزال جميع أيونات المعدن بتشكيلها معقدا مع الEdta .
ومن الهام بالطبع ألا يشكل المشعر المستعمل مع الأيون المعدني معقدا أقوى من الي يشكله ال Edta مع أيونات المعدن ، لأنه في هذه الحالة لايمكن تعيين نقطة نهاية المعايرة .
لذلك تستخدم المركبات العضوية الملونة التي تكون مع الأيون المعدني المدروسة معقدات ضعيفة الثبات كمشعرات أثناء المعايرة بالتعقيد ، حيث يختلف لون المشعر أثناء تشكيله معقد مع الأيون المعدني عن لون المشعر الحر .
ومن أهم المشعرات المستخدمة في معايرات المعقدات :
1- مشعر الموروكسيد :
إن لون هذا المشعر وهو بشكل صلب أحمر داكن ، وإن لونه في المحلول يتغير تبعا لقيمة ph الوسط .
وصيغته العامة NH4(C8O6H5N5)H2O ويشكل الموركسيد مع الايونات المعدنية ، معقدات ذات لون وردي أو أصفر تبعا لنوعية الكاتيون ، وعندما يتفكك هذا المعقد تحت تأثير تفاعل الEdta مع الأيونات المعدنية التي أخذها من معقد المشعر ، يعود اللون الأصلي للمشعر بالظهور .
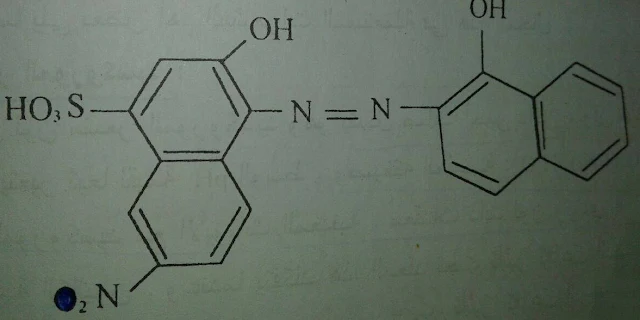
2-مشعر الأريوكروم الأسود- T :
(Eriochrome black T)
ذو لون أسود يذوب في الكحول ، إلا أن محاليله غير ثابتة مع الزمن ولهذا يفضل تحضير مزيج جاف من الأريوكروم بلاك T مع ملح كلوريد الصوديوم بنسبة (1:200)غ يكون لون المشعر في الوسط القلوي والمعتدل أزرق ، وهو يشكل معقدات مع عدد كبير من الأيونات وبخاصة مع Mg+2 ليعطي لونا احمر خمريا ويمتلك هذا المشعر الصيغة التالية :
3- مشعر أزرق ميتيل التيمول :
يكون لون المشعر عند اتحاده مع الايونات المعدنية غالبا أزرق ، وعند عودته إلى الشكل الأصلي يصبح ذا لون أصفر ليموني .
يستعمل هذا المشعر لتحديد الأيونات المعدنية الثلاثية التكافؤ والثنائية عند قيمة pH<7.2
4- مشعر برتقالي الكزيلينول :
يمكن استخدام هذا المشعر لمعايرة المعادن التالية مباشرة : البزموت ، السكانديوم ، عند قيمة حموضة pH=2-3 , والزنك والرصاص والزئبق عند pH=5-6 حيث يشكل مع الايونات المعدنية معقدات وردية اللون ، وعندما يصبح حرا في المحلول يظهر اللون الأصفر .
كما يوجد أنواع أخرى عديدة من المشعرات التي يمكن أستخدامها في معايرات الEdta منها أرجواني الفتالئين ، الكالكون والديتيزون .