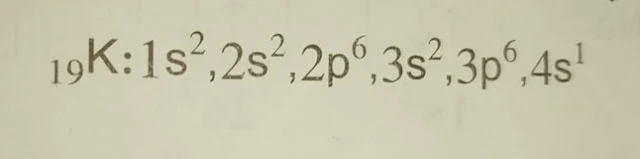العلاقات الدورية بين العناصر 2Periodic relationships among the elements
تحدثنا سابقاً عن المجموعات العمودية في الجدول الدوري واستكمالاَ لهذا الموضوع سنتحدث عن الأدوار الأفقية في الجدول الدوري .
الأدوار الأفقية في الجدول الدوري
ترتب العناصر في الجدول الدوري ضمن صفوف أفقية تُعرف بالأدوار
حيث يزداد كل عنصر في الدور الواحد بالكترون واحد عن العنصر الذي يسبقه
ويتم ذلك في سبعة أدوار كما يلي :
1- الدور الأفقي الأول في الجدول الدوري:
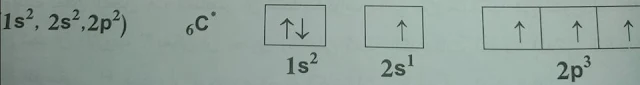
ويحتوي على عنصرين فقط هما الهيدروجين H والهيليوم He. وتحتوي ذرة الهيدروجين على إلكترون واحد يشغل الفلك s وهو أقل الأفلاك من حيث الطاقة.
ويمثل التشكيل الإلكتروني لذرة الهيدروجين 1^1s ويُلاحظ أن ذرة الهيدروجين تحتوي على إلكترون واحد منفرد فيكون تكافؤها أحادياً. ثم يأتي بعد ذلك عنصر الهيليوم وعدده الذري 2 فهو يزيد عن الهيدروجين بإلكترون واحد ويشغل أيضاً الفلك s حيث تكتمل هذه الطبقة بإلكترونين ويصبح التشكيل الإلكتروني لذرة الهيليوم هو 1s^2 يُلاحظ أن ذرة الهيليوم تحتوي على إلكترونين في المدار الخارجي وبذلك فتكافؤها يساوي الصفر.
2- الدور الأفقي الثاني في الجدول الدوري :
يبدأ هذا الدور بعنصر الليثيوم Li وينتهي بعنصر النيون Ne، والعدد الذري لليثيوم هو 3 وبذلك يدخل الإلكترون الثالث إلى الطبقة الثانية التي تحتوي على طبقتين فرعيتين هما 2s وبها فلك واحد و 2p وبها ثلاثة أفلاك متكافئة.
وطاقة الطبقة 2s أقل من طاقة الطبقة 2p ولذلك يدخل الإلكترون الثالث في ذرة الليثيوم إلى الطبقة 2s ويكون التشكيل الإلكتروني لذرة الليثيوم هو 1s^2 2s^1 والذي يمكن تمثيله كما يلي :
ونُلاحظ أن الليثيوم يحتوي على إلكترون منفرد في المدار الخارجي وبذلك فهو أحادي التكافؤ.
ثم يأتي بعد ذلك عنصر البريليوم Be حيث يدخل الإلكترون الرابع إلى الفلك 2s أيضاً.
وكما نُلاحظ فإن البريليوم يحتوي على زوج من الإلكترونات في المدار الخارجي ولذلك يتوقع أن يكون تكافؤه مساوياَ للصفر.
ولكن نجد أن المشاهدات العملية تدلُّ على أن البريليوم ثنائي التكافؤ. ويمكن تفسير ذلك بأن إلكتروناً من الفلك 2s يثار بقدر قليل من الطاقة ويحتل أحد أفلاك الطبقة 2p ويمكن تمثيل التشكيل الإلكتروني لذرة البريليوم في حالتها الأساسية وفي حالتها المثارة على النحو التالي
يُلاحظ مما تقدم أنه لايمكن في حالة الهيليوم إثارة إلكترون من الطبقة 1s إلى الطبقة 2s لأن ذلك يتطلب كمية كبيرة من الطاقة لا تتوفر في التفاعلات الكيميائية العادية حيث أن الطبقة 1s تنتمي إلى مستوى الطاقة الأول بينما تنتمي 2s إلى المستوى الثاني في الذرة.
ثم يأتي بعد ذلك عنصر البورون B وعدده الذري 5 والذي يكون تكافؤه أحادياً في حالته الأساسية وتكافؤه ثلاثي في حالته المثارة. ويأتي بعده عنصر الكربون C وعدده الذري 6 ويمكن تمثيل تشكيله الإلكتروني
كما يلي:
ويمكن أن يثار أحد إلكتروني الطبقة 2s إلى الطبقة 2p ويكون التشكيل الإلكتروني لذرة الكربون المثارة * C هو:
ويُلاحظ أن ذرة الكربون المثارة تحتوي على أربع إلكترونات منفردة ويكون الكربون بذلك رباعي التكافؤ.
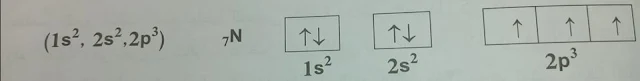
ثم يأتي بعد ذلك عنصر الآزوت N وعدده الذري 7 ويكون التشكيل الألكتروني له هو :
وهو يحتوي على ثلاثة إلكترونات منفردة في المدار الخارجي ولذلك فإن تكافؤ الآزوت ثلاثي .
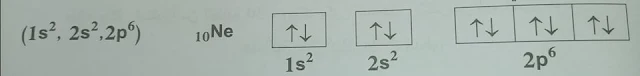
وبطريقة نفسها نستنتج أن عنصر الأوكسجين O وعدده الذري 8 هو ثنائي التكافؤ. وعنصر الفلور F وعدده الذري 9 هو أحادي التكافؤ. ينتهي هذا الدور بعنصر النيون Ne وعدده الذري 10 حيث تزدوج جميع الإلكترونات ويصبح تكافؤه صفراً ويكون تشكيله الإلكتروني كما يلي :
3- الدور الأفقي الثالث في الجدول الدوري :
يبدأ هذا الدور بعنصر الصوديوم Na وينتهي بعنصر الأرجون Ar ويمكن كتابة التشكيل الإلكتروني لعناصر هذا الدور على أساس أن تشكيل ذرة الصوديوم هو في الواقع ذرة نيون Ne مع إضافة إلكترون على الشكل التالي :
يتضح مما سبق أن التشكيل الإلكتروني لهذه العناصر يشبه التشكيل الإلكتروني لعناصر الدور الثاني إلاّ أن إلكترونات التكافؤ توجد في مدار إلكتروني أعلى وهو المدار الثالث.
ولكن المدار الثالث يحتوي بالإضافة إلى الطبقتين الفرعيتين s و p على طبقة فرعية ثالثة وهي الطبقة 3d ووجود هذه الطبقة يسهل إثارة الإلكترونات إليها من الطبقتين s و p وبذلك يمكن لبعض هذه العناصر أن تتخذ تكافؤات أعلى من مثيلاتها في الدور السابق .
- ففي حين نجد أن الآزوت لا يمكن أن يحتوي إلا على ثلاثة إلكترونات منفردة (ثلاثي التكافؤ) نُلاحظ أن الفوسفور P يمكن أن توجد به 5 إلكترونات منفردة (خماسي التكافؤ).
- وفي الحالة الأساسية الغير مثارة فإن تكافؤات عناصر المجموعة نفسها في الدورين الثاني والثالث يكون واحداً.
- أما في الحالة المثارة فيُلاحظ أن تكافؤات عناصر الدور الثالث تبلغ نهايتها العظمى بالنسبة لعناصر الفصائل 5,6,7 وهو يساوي رقم الفصيلة في حين أن تكافؤات عناصر الدور الثاني لهذه الفصائل لا يتغير في الحالة المثارة عنه في الحالة الأساسية. ولهذا يمكن عَد عناصر الدور الثالث تمثل دورها تمثيلاً حقيقياً أكثر من الدور الثاني.
4- الدور الأفقي الرابع في الجدول الدوري :
<><>4- الدور الأفقي الرابع في الجدول الدوري :
يبدأ هذا الدور بعنصر البوتاسيوم K وعدده الذري 19 حيث يدخل الإلكترون التاسع عشر الطبقة 4s ولا يدخل في الطبقة 3d على الرغم من أن الطبقة 3d تنتمي إلى المدار الثالث بينما تنتمي الطبقة 4s إلى المدار الرابع، إلا أنها أقل طاقة وأكثر استقراراً من الطبقة 3d وبذلك يكون التشكيل الإلكتروني للبوتاسيوم هو :
أو يمكن كتابته على الشكل التالي :
وكما هو ملاحظ فإنه يوجد إلكترون منفرد في المدار الخارجي وبذلك يكون البوتاسيوم أحادي التكافؤ.
ثم يليه عنصر الكالسيوم Ca وعدده الذري 20 وله التشكيل الإلكتروني:
ثم يليه عنصر الكالسيوم Ca وعدده الذري 20 وله التشكيل الإلكتروني:
أو يمكن كتابته على الشكل :
ثم يبدأ بعد ذلك امتلاء الطبقة d وهي تحتوي على خمسة أفلاك ولذلك فهي تستوعب عشرة إلكترونات، وتمثلها عشرة عناصر تُعرف بالسلسلة الانتقالية الأولى والتي تسمى بالسلسلة 3d، حيث تمتلئ فيها الطبقة 3d وهذه الطبقة تكون أكثر استقراراً وهي ممتلئة أو نصف ممتلئة .
وتبدأ هذه السلسلة بعنصر السكانديوم Sc وتنتهي بعنصر الزنك Zn وكما ذكرنا فإن الطبقة 3d تكون أكثر استقراراً عندما تحتوي على 10 إلكترونات كما في الزنك أو عندما تحتوي على 5 إلكترونات كما في الكروم Cr.
ولذلك نلاحظ أن التشكيل الإلكتروني للكروم هو:
بدلاً من :
كذلك نجد أن النحاس له التشكيل الإلكتروني التالي :
بدلاً من :
وبعد امتلاء الطبقة 3d في الزنك يبدأ امتلاء الطبقة 4p والتي تستوعب 6 إلكترونات وتبدأ بعنصر الغاليوم Ga والذي عدده الذري 31 وتنتهي بعنصر الكريبتون Kr الخامل ذي العدد الذري 36.
يمكن تصنيف عناصر الدور الرابع ضمن ثلاث فئات وهي:
- عناصر يدخل فيها الإلكترون إلى الطبقة 4s وهي البوتاسيوم K والكالسيوم Ca
- عناصر يدخل فيها الإلكترون إلى الطبقة 4p وهي العناصر من الجاليوم Ga إلى الكريبتون Kr
- عناصر يدخل فيها الإلكترون إلى الطبقة 3d وهي العناصر من السكانديوم Sc إلى الزنك Zn.
5- الدورالأفقي الخامس في الجدول الدوري :
يبدأ هذا الدور بعنصر الروبيديوم Rb وينتهي بالغاز النبيل الكزيتون Xe ويشبه تشكيل عناصر هذا الدور عناصر الدور السابق، من حيث التشكيل الإلكتروني ونوع الطبقات التي تدخل فيها الإلكترونات.
يمكن تصنيف عناصر هذا الدور إلى الفئات الثلاثة نفسها المذكورة في الدور السابق.
ويلاحظ في هذا الدور أن الطبقة 5s تمتلئ
قبل 4d، كما امتلأت الطبقة 4s قبل 3d في الدور السابق.
6- الدور الأفقي السادس في الجدول الدوري :
يشمل هذا الدور على 32 عنصر. ويتميز عن الدور السابق بوجود الطبقة 4f ويكون تشكيل امتلاء الطبقات في هذا الدور على الشكل التالي :
- امتلاء الطبقة 6s في عنصري السيزيوم Cs والباريوم Ba.
- البدء بملء الطبقة 5d في عنصر اللانثانيوم La.
- امتلاء الطبقة 4f في عناصر اللانثانيدات التي تبدأ بعنصر السيريوم Ce وتنتهي بعنصر اللوتيسيوم Lu.
- امتلاء بقية الطبقة 5d التي كانت قد بدأت في عنصر اللانثانيوم La حتى يتم امتلاؤها في عنصر الزئبق Hg.
- امتلاء الطبقة 6p في العناصر التي تبدأ بعنصر الثاليوم Ti والتي تنتهي بغاز الرادون Rn وهو غاز نبيل.
- تعرف عناصر اللانثانيدات والتي تحتوي على 14 عنصراً تشكلت بالتزايد التدريجي لامتلاء الطبقة الداخلية 4f بالعناصر الانتقالية الداخلية لأن الإلكترون المضاف يدخل الطبقة الداخلية 4f والتي تقع قبل طبقتين خارجيتين هما 5d و 6s.
7- الدور الأفقي السابع في الجدول الدوري :
يحتوي هذا الدور على 17 عنصر فقط، اثنان من هذه العناصر وهما الفرانسيوم Fr والراديوم Ra يشبهان السيزيوم Cs والباريوم Ba في الدور السابق، وتمتلئ فيها الطبقة 7s. ثم يأتي عنصر الأكتينيوم Ac وهو يشبه عنصر اللانثانيوم La وفيه يبدأ امتلاء الطبقة 6d.
يأتي بعد ذلك 14 عنصراً تشبه عناصر اللانثانيدات وتمتلئ فيها الطبقة 5f وهي أيضاً عناصر انتقالية داخلية تسمى الأكتينيدات. وإذا قارنا هذا الدور بالدور السابق نجد أنه ينقص عنه ب15 عنصراً تسعة منها انتقالية، وهي التي بدأت بالأكتينيوم ولم تكتمل بعد، وستة عناصر غير انتقالية من المفروض أن تنتهي بغاز خامل ولكن هذه العناصر 15 لم تكتشف بعد.
وبذلك يتضح أن الجدول الدوري الآن يحتوي على 103 عنصراً، والمفروض أن يحتوي على 118 عنصراً إذا افترضنا أن الدور الأخير السابق يجب أن يحتوي على 32 عنصراً كالدور السابق.