التحاليل الكيميائية للمياه - قساوة المياه
بعد أن تعرفنا في مقال سابق عن كيمياء الماء وأهم خصائصها الفيزيائية والكيميائية سنتابع اليوم التعرف على أهم التحاليل الكيميائية لعينات الماء .
- ننقل المحلول كميا إلى بالون معايرة( 100ml) ونتمم الحجم بالماء المقطر .
- يتم تقييسه (ضبط تركيزه) بواسطة محلول الكالسيوم القياسي الذي حضرناه في المرحلة 1 .
نضع 54غ من كلوريد الأمونيوم NH4Cl ونضيف 350 من ماءات الامونيوم المركزة NH4OH ، ثم نمدد الحجم حتى 1000مل بالماء المقطر .
- يقوم محلول الEDTA بتعقيد جميع أملاح الكالسيوم والمغنزيوم المنحلة .
ثم نجري الحسابات اللازمة من خلال العلاقة :
(N1 . V1) = (N2 . V2)
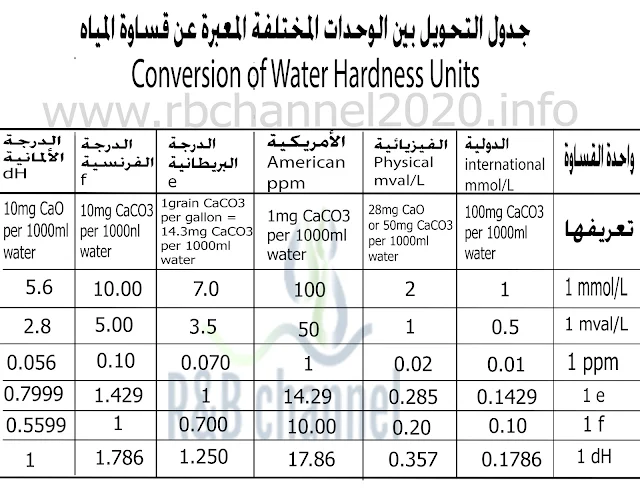
وتكون واحدة القساوة بmg/L
ناخذ العينة ونتمم الحجم إلى 100 مل بالماء المقطر .
ثم نقوم بالخطوات نفسها التي اجريناها لتحديد القساوة الكلية .
أولا - قساوة الماء (Water Hardness)
* تحضير الكواشف والمحاليل المطلوبة :
1- محلول كالسيوم قياسي :
- نضع 1غ من كربونات الكالسيوم اللامائية CaCO3 في بيشر سعة (500مل) نضيف محلول حمض كلور الماء (1:1) على دفعات حتى الانحلال الكامل لكربونات الكالسيوم ، نضيف 200 مل من الماء المقطر ويغلى المحلول عدة دقائق ثم يبرد ، نضيف قطرات من مشعر أحمر الميتيل ويعدل الوسط باستخدام ماءات الامونيوم(NH4OH) او حمض كلور الماء(HCL) الممدين حتى أنقلاب لون المشعر إلى البرتقالي .- ننقل المحلول كميا إلى بالون معايرة( 100ml) ونتمم الحجم بالماء المقطر .
2- محلول (0.01M) من الEDTA :
نذيب 3.723غ من الEDTA بالماء المقطر ونتمم الحجم إلى 1000مل .- يتم تقييسه (ضبط تركيزه) بواسطة محلول الكالسيوم القياسي الذي حضرناه في المرحلة 1 .
3- محلول موقي قلوي :
(ملاحظة) المحلول الموقي هو المحلول الذي يحافظ على قيم الph إلى حد ما عند إضافة كمية محدودة من الحمض او الأساس ، ويكون أما حمض ضعيف (Acid) مع أحد أملاحه أو قلوي ضعيف (base) مع أحد أملاحه .نضع 54غ من كلوريد الأمونيوم NH4Cl ونضيف 350 من ماءات الامونيوم المركزة NH4OH ، ثم نمدد الحجم حتى 1000مل بالماء المقطر .
4- مشعر أسود الأريكروم T :
نطحن 1g منه مع 100g كلوريد الصوديوم NaCl , ونستخدمه بشكله الصلب .
طريقة العمل :
1- تحديد القساوة الكلية (TH (Total Hardness
- نأخذ 100 مل من العينة المراد تحليلها ، ونضيف المحلول الموقي الذي حضرناه للحصول على PH =10 ونضع 0.1g من مشعر أسود أريكروم T ونقوم بالمعايرة بمحلول الEDTA.- يقوم محلول الEDTA بتعقيد جميع أملاح الكالسيوم والمغنزيوم المنحلة .
ثم نجري الحسابات اللازمة من خلال العلاقة :
(N1 . V1) = (N2 . V2)
وتكون واحدة القساوة بmg/L
- تحديد القساوة الدائمة (Permanent Hardness)
القساوة الدائمة هي املاح الكالسيوم والمغنزيوم المنحلة التي لايمكن إزالتها بالغليان (أي المتبقية بعد غليان الماء ) - نقوم بغلي العينة المطلوبة لمدة 5 دقائق ثم تبرد فتتحول املاح البيكربونات المنحلة إلى كربونات راسبة .ناخذ العينة ونتمم الحجم إلى 100 مل بالماء المقطر .
ثم نقوم بالخطوات نفسها التي اجريناها لتحديد القساوة الكلية .
3- تحديد القساوة المؤقتة (Temporary Hardness)
القساوة المؤقتة تساوي القساوة الكلية مطروحا منها القساوة الدائمة .ثانيا- تحديد تركيز شوارد الكلور Cl في الماء (طريقة القياس الفضي المعيارية )
* تحضير الكواشف والمحاليل المطلوبة :
[NaCl (0.03N) - AgNO3 (0.03N) - K2Cro4 ]
1- محلول نترات الفضة (AgNO3 (0.03N
نذيب 5.0967g من نترات الفضة بالماء المقطر ، ونتمم الحجم إلى 1000مل . نقوم بتقييسه (ضبط تركيزه) بمحلول قياسي من كلوريد الصوديوم NaCl تركيزه (0.03N)
- محلول مشعر : نذيب 50g من كرومات البوتاسيوم K2CrO4 في قليل من الماء المقطر ، ونضيف له محلول نترات الفضة حتى يتشكل راسب أحمر ، ونتركه 12 ساعة ليرقد ثم نرشحه ونمدد الحجم بالماء المقطر حتى 1000 مل .
* طريقة العمل :
تسمى هذه الطريقة (معايرة مور ) والتي تعتمد على تشكيل راسب ابيض من كلوريد الفضة AgCl أثناء المعايرة
وتكون نقطة نهاية المعايرة عندما يتشكل راسب احمر من كرومات الفضة Ag2CrO4
سبب تشكل راسب AgCl أولا وليس راسب كرومات الفضة AgCro4 هو الاختلاف في ثوابت جداء الانحلال .
- نأخذ 100 مل من العينة ، نضبط الPH في المجال (7-9) باستخدام حمض الكبريت H2SO4 أو ماءات الصوديوم NaOH , نضيف 1مل من محلول مشعر الكرومات ، ونعاير بمحلول نترات الفضة المقيس حتى الوصول إلى نقطة نهاية صفراء قرمزية . ثم نجري الحسابات الرياضية اللازمة .
ثالثا : تحديد تركيز شوارد الكالسيوم Ca في الماء (طريقة المعايرة بالEDTA المعيارية )
* تحضير الكواشف والمحاليل المطلوبة :
1- محلول (0.01M) من الEDTA :
نذيب 3.723غ من الEDTA بالماء المقطر ونتمم الحجم إلى 1000مل . - يتم تقييسه (ضبط تركيزه) بواسطة محلول الكالسيوم القياسي
2- مشعر الميروكسيد (Murexide)
نطحن 200mg منه مع 100g من كلوريد الصوديوم NaCl ونستخدمه بالشكل الصلب .
3- محلول 1N من ماءات الصوديوم NaOH
طريقة العمل :
- نأخذ 50 مل من العينة ونمدد حتى 100مل بالماء المقطر .
- نضيف حجم مناسب من ماءات الصوديوم حتى نحصل على (PH=12-13) .
- نضع 0.1g من مشعر الميروكسيد ثم نعاير ببطء بواسطة الEDTA حتى أنقلاب لون المشعر من الوردي إلى الأرجواني .
ثم نجري الحسابات الرياضية اللازمة .
رابعا- تحديد تركيز شوارد المغنزيوم Mg في الماء (الطريقة الحسابية المعيارية)
بعد ان قمنا بتحديد القساوة الكلية وتحديد تركيز شوارد الكالسيوم في العينة نستطيع تقدير تركيز شوارد المغنزيوم فيها بحساب الفرق بين القساوة الكلية وبين تركيز شوارد الكالسيوم معبرا عنها ب CaCO3 .
خامسا - تحديد القلوية الكليةTotal Alkalinity) TA) وشوارد الكربونات CO3 وشوارد البيكربونات HCO3
الكواشف والمحاليل المطلوبة :
1- محلول 0.1N من حمض كلور الماء .
2- مشعر الفينول فتالئين .
3- مشعر أحمر الميتيل .
1- محلول 0.1N من حمض كلور الماء .
2- مشعر الفينول فتالئين .
3- مشعر أحمر الميتيل .
طريقة العمل :
معايرة حمض بأساس , حيث نأخذ 50 مل من العينة ونضيف لها أحمر الميتيل والفينول فتالئين ونعاير حتى أنقلاب اللون .
معايرة حمض بأساس , حيث نأخذ 50 مل من العينة ونضيف لها أحمر الميتيل والفينول فتالئين ونعاير حتى أنقلاب اللون .
سادسا : تركيز الاملاح المنحلة الكلية TDS وتعين ناقلية المياه :
يتم قياسها مباشرة باستخدام جهاز قياس الناقلية . ويمكن اخذ عينة ماء وتبخير حجم معلوم منها وحساب وزن الاملاح المترسبة ومقارنة النتيجة مع نتيجة جهاز الناقلية .
سنتابع لاحقا طرق تحديد تركيز شوارد الكبريتات SO4 وقرينة لانجولييهLangelier وقرينة الثباتية وفق Ryznar